Mg bånd får lov til at reagere med hcl og en anden ch3cooh, hvor brusende vil opstå kraftigere hvorfor?
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
På den anden side, når magnesiumbånd reagerer med eddikesyre (CH3COOH), en svagere syre sammenlignet med HCl, gennemgår det også en enkelt-fortrængningsreaktion. Imidlertid forløber reaktionen med en langsommere hastighed på grund af den lavere surhedsgrad af eddikesyre. Den kemiske ligning for denne reaktion er:
Mg(s) + 2CH3COOH(aq) → Mg(CH3COO)2(aq) + H2(g)
Sammenlignes de to reaktioner, sker reaktionen mellem Mg og HCl kraftigere, hvilket resulterer i hurtigere brusende. Denne forskel kan tilskrives styrken af de involverede syrer. Saltsyre er en stærk syre, der dissocierer fuldstændigt i vand og frigiver en høj koncentration af hydrogenioner (H+). Disse H+ ioner reagerer hurtigt med Mg, hvilket fører til hurtig produktion af brintgas og kraftigere brusende.
I modsætning hertil er eddikesyre en svag syre, der kun delvist dissocierer i vand og frigiver en lavere koncentration af hydrogenioner. Dette resulterer i en langsommere reaktion med Mg og en mindre kraftig frigivelse af brintgas, hvilket fører til mindre brusende.
 Varme artikler
Varme artikler
-
 Elektriske ledningsegenskaber for DNA forbundet med kræftKredit:CC0 Public Domain En af de største hjælpere i vores krops igangværende bestræbelser på at forhindre DNA -mutationer - mutationer, der kan føre til kræft - er faktisk ret små. Elektroner, de
Elektriske ledningsegenskaber for DNA forbundet med kræftKredit:CC0 Public Domain En af de største hjælpere i vores krops igangværende bestræbelser på at forhindre DNA -mutationer - mutationer, der kan føre til kræft - er faktisk ret små. Elektroner, de -
 Kunstig fotosyntese får et stort løft fra ny katalysatorPhil De Luna er en af hovedforfatterne til et nyt papir offentliggjort i Nature Chemistry, der rapporterer en lavpris, højeffektiv katalysator til kemisk omdannelse af vand til oxygen. Katalysatoren
Kunstig fotosyntese får et stort løft fra ny katalysatorPhil De Luna er en af hovedforfatterne til et nyt papir offentliggjort i Nature Chemistry, der rapporterer en lavpris, højeffektiv katalysator til kemisk omdannelse af vand til oxygen. Katalysatoren -
 Selv efter håndvask, ny fngerprint test kan skelne mellem dem, der har taget eller håndteret heroi…Kredit:CC0 Public Domain En avanceret fingeraftryksdetektionsteknologi kan identificere spor af heroin på menneskelig hud, selv efter at nogen har vasket deres hænder – og det er også smart nok at
Selv efter håndvask, ny fngerprint test kan skelne mellem dem, der har taget eller håndteret heroi…Kredit:CC0 Public Domain En avanceret fingeraftryksdetektionsteknologi kan identificere spor af heroin på menneskelig hud, selv efter at nogen har vasket deres hænder – og det er også smart nok at -
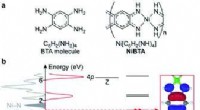 Forskere afdækker arbejdsprincipperne for et lovende materiale til hurtigopladning af batterier(a) Formler for BTA-molekyle og NiBTA og (b) elektronisk struktur af NiBTA. Den elektroniske struktur er opdelt i σ- og π-systemer. π-systemet dekomponeres yderligere i LMOer af Ni- og BTA-blokke. Tæt
Forskere afdækker arbejdsprincipperne for et lovende materiale til hurtigopladning af batterier(a) Formler for BTA-molekyle og NiBTA og (b) elektronisk struktur af NiBTA. Den elektroniske struktur er opdelt i σ- og π-systemer. π-systemet dekomponeres yderligere i LMOer af Ni- og BTA-blokke. Tæt
- Hvordan reproducerer organer i Kongeriget Protista?
- Olie, hvordan raffinering fungerer
- En lagdelt nanostruktur holdt sammen af DNA
- Professorer udgiver papir om køn og racemæssige skævheder i fysik lærebøger
- Hvordan droner kan overvåge eksplosive vulkaner
- Irma mistede en smule over Cuba inden angrebet på Florida


