Hvorfor er gas lettere at komprimere end en væske eller et fast stof?
Her er en mere detaljeret forklaring:
* Gas: Molekylerne i en gas bevæger sig konstant og kolliderer med hinanden og væggene i deres beholder. Når en gas komprimeres, har molekylerne mindre plads til at bevæge sig og kolliderer oftere med hinanden. Dette får gassens tryk til at stige.
* Væske: Molekylerne i en væske bevæger sig også konstant, men de er tættere på hinanden end molekylerne i en gas. Det betyder, at de har mindre plads til at bevæge sig og kolliderer med hinanden oftere. Molekylerne i en væske bliver dog også tiltrukket af hinanden af intermolekylære kræfter. Disse kræfter er med til at holde molekylerne sammen og gør det sværere at komprimere væsken.
* Solid: Molekylerne i et fast stof er meget tæt på hinanden og holdes på plads af stærke intermolekylære kræfter. Dette gør det meget vanskeligt at komprimere et fast stof.
Et stofs komprimerbarhed er et mål for, hvor let det kan komprimeres. Kompressibiliteten af en gas er meget højere end komprimerbarheden af en væske eller et fast stof. Det betyder, at det er meget nemmere at komprimere en gas end en væske eller et fast stof.
 Varme artikler
Varme artikler
-
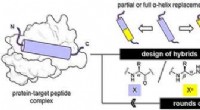 Oligourea foldamerer efterligner peptider alfa-helices og binder effektivt til lægemiddelmålKredit:Wiley Nogle nyttige lægemidler består af peptider, der virker på deres proteinmål. For at gøre dem mere effektive og stabile, forskere har fundet en måde at erstatte afgørende segmenter af
Oligourea foldamerer efterligner peptider alfa-helices og binder effektivt til lægemiddelmålKredit:Wiley Nogle nyttige lægemidler består af peptider, der virker på deres proteinmål. For at gøre dem mere effektive og stabile, forskere har fundet en måde at erstatte afgørende segmenter af -
 Forskere udvikler semi-flydende metalanode til næste generations batterierCarnegie Mellon-forskere har udviklet en dobbeltledende polymer/carbon-kompositmatrix med lithiummikropartikler, der kan bruges som elektrode i næste generations batterier. Kredit:Carnegie Mellon Univ
Forskere udvikler semi-flydende metalanode til næste generations batterierCarnegie Mellon-forskere har udviklet en dobbeltledende polymer/carbon-kompositmatrix med lithiummikropartikler, der kan bruges som elektrode i næste generations batterier. Kredit:Carnegie Mellon Univ -
 Detektering af kemiske midler med tillidEn Joint Chemical Agent Detector udstyret med en tærskelsikkerhedskontrol i sort, På toppen. Kredit:Jason Stoughton/NIST Joint Chemical Agent Detector (JCAD) er blevet et vigtigt forsvarsværktøj p
Detektering af kemiske midler med tillidEn Joint Chemical Agent Detector udstyret med en tærskelsikkerhedskontrol i sort, På toppen. Kredit:Jason Stoughton/NIST Joint Chemical Agent Detector (JCAD) er blevet et vigtigt forsvarsværktøj p -
 Bekræftelse af stamtavlen for urankuber fra Nazitysklands mislykkede atomprogramRobertson med PNNLs terning, som er i et beskyttende etui. Kredit:Andrea Starr/PNNL Under Anden Verdenskrig, Nazityskland og USA var kapløb om at udvikle nuklear teknologi. Før Tyskland kunne lykk
Bekræftelse af stamtavlen for urankuber fra Nazitysklands mislykkede atomprogramRobertson med PNNLs terning, som er i et beskyttende etui. Kredit:Andrea Starr/PNNL Under Anden Verdenskrig, Nazityskland og USA var kapløb om at udvikle nuklear teknologi. Før Tyskland kunne lykk
- Modellering af exoplanetatmosfærer
- Nye rytterdata viser, hvordan offentlig transport reducerer udledningen af drivhusgasser og forure…
- Hvor mange atomer er der i natriumcitrat?
- Hele romerske by afsløret uden gravning
- Alibaba, Det russiske teknologifirma Mail.ru er enige om fælles e-handelsprojekt
- Three Gorges Dam:Ven eller fjende af drivhusgasser fra floden?


