Hvordan skabes en brintbinding?
1. Elektronegativitetsforskel :Elektronegativitetsforskellen mellem de hydrogenbundne atomer er afgørende. Elektronegativitet måler et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding. Hydrogenbindinger er stærkest, når elektronegativitetsforskellen er signifikant.
2. Polær kovalent binding :Når hydrogen er kovalent bundet til et elektronegativt atom (f.eks. N, O eller F) i et molekyle, trækker det elektronegative atom det delte elektronpar tættere på sig selv, hvilket skaber en polær kovalent binding. Dette resulterer i en delvis positiv ladning på hydrogenatomet (δ+) og en delvis negativ ladning på det elektronegative atom (δ-).
3. Elektrostatisk tiltrækning :I et andet molekyle, når et elektronegativt atom har ensomme elektronpar (f.eks. enlige par på N, O eller F), kan det tiltrække det delvist positivt ladede hydrogenatom fra den polære kovalente binding. Denne tiltrækning mellem de modsatte partielle ladninger danner hydrogenbindingen.
I det væsentlige er en hydrogenbinding en tiltrækkende kraft mellem et brintatom, der deltager i en polær kovalent binding, og et elektronegativt atom, der indeholder ensomme elektronpar, som følge af elektrostatiske interaktioner. Disse bindinger spiller afgørende roller i forskellige kemiske og biologiske systemer, herunder vand, proteiner og DNA.
Sidste artikelHvad er ionforbindelsen for natriumbicarbonat?
Næste artikelHvem er stærkest intermolekylær eller hydrogenbinding?
 Varme artikler
Varme artikler
-
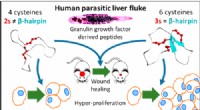 Et molekyle produceret af en thailandsk leverparasit kan være løsningen på de ikke-helende sårKredit:ACS Hver dag amputeres 12 australske diabetikere på grund af et sår, der ikke heler. Globalt set det er en hvert 30. sekund. Et molekyle produceret af en thailandsk leverparasit kan være l
Et molekyle produceret af en thailandsk leverparasit kan være løsningen på de ikke-helende sårKredit:ACS Hver dag amputeres 12 australske diabetikere på grund af et sår, der ikke heler. Globalt set det er en hvert 30. sekund. Et molekyle produceret af en thailandsk leverparasit kan være l -
 En ny teknik til at slette enkelte atomer kan fremskynde molekyledesignAsst. Prof. Mark Levin (til venstre) og ph.d. studerende Jisoo Woo på arbejde i laboratoriet på University of Chicago. Kredit:Jason Thome Hver gang der annonceres et nyt kræftlægemiddel, repræsente
En ny teknik til at slette enkelte atomer kan fremskynde molekyledesignAsst. Prof. Mark Levin (til venstre) og ph.d. studerende Jisoo Woo på arbejde i laboratoriet på University of Chicago. Kredit:Jason Thome Hver gang der annonceres et nyt kræftlægemiddel, repræsente -
 Molekyler omdanner synligt lys til ultraviolet lys med rekordeffektivitetEt nyudviklet molekylært system i glasrøret til højre opkonverterer effektivt synligt lys selv fra typiske LEDer til ultraviolet lys gennem triplet-triplet udslettelse. Udviklet af forskere ved Kyushu
Molekyler omdanner synligt lys til ultraviolet lys med rekordeffektivitetEt nyudviklet molekylært system i glasrøret til højre opkonverterer effektivt synligt lys selv fra typiske LEDer til ultraviolet lys gennem triplet-triplet udslettelse. Udviklet af forskere ved Kyushu -
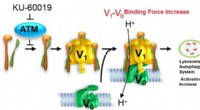 Forskere rapporterer hæmning af cellulær aldringOpdag nøglen til at afsløre hemmeligheden bag reversibel aldringsopsving. Kredit:DGIST Aldring er en forringelse af en celles evne til at dele sig og vokse, når den bliver ældre. Dette forårsager
Forskere rapporterer hæmning af cellulær aldringOpdag nøglen til at afsløre hemmeligheden bag reversibel aldringsopsving. Kredit:DGIST Aldring er en forringelse af en celles evne til at dele sig og vokse, når den bliver ældre. Dette forårsager
- 10 skøre former for alternativ energi
- Acid Rain Effects on Plants & Animals
- Hvad kan man lære af mikroberne på en skildpaddes skal?
- Deep learning kunstig intelligens holder øje med vulkanens bevægelser
- Hvordan lærer neurale netværk? En matematisk formel forklarer, hvordan de opdager relevante mønst…
- Begrænsning af global opvarmning ved CO2 -lagring? Kontroller kontinentalt stress


