Hvem er stærkest intermolekylær eller hydrogenbinding?
Intermolekylære kræfter er de kræfter, der holder molekyler sammen i en forbindelse. De er svagere end kemiske bindinger, som holder atomer sammen i et molekyle. Hydrogenbindinger er en type intermolekylær kraft, der opstår, når et brintatom er bundet til et meget elektronegativt atom, såsom fluor, oxygen eller nitrogen. Det elektronegative atom trækker elektronerne væk fra brintatomet, hvilket skaber en delvis positiv ladning på brintatomet. Denne delvise positive ladning kan derefter tiltrække den delvise negative ladning på et andet elektronegativt atom og danne en hydrogenbinding.
Hydrogenbindinger er stærkere end andre intermolekylære kræfter, fordi de er elektrostatiske i naturen. Elektrostatiske kræfter er stærkere end van der Waals-kræfter, som er den anden type intermolekylær kraft. Van der Waals kræfter er forårsaget af de midlertidige fluktuationer i molekylernes elektronskyer.
Styrken af en hydrogenbinding afhænger af elektronegativiteten af de involverede atomer og afstanden mellem atomerne. Jo mere elektronegative atomerne er, jo stærkere er hydrogenbindingen. Jo kortere afstanden mellem atomerne er, jo stærkere er hydrogenbindingen.
Sidste artikelHvordan skabes en brintbinding?
Næste artikelHvad er pH-værdien 5, der findes i syre?
 Varme artikler
Varme artikler
-
 MIT opstart pakker mad ind i silke for bedre holdbarhedEn spiselig silkebaseret belægning udviklet af MIT-adjunkt Benedetto Marelli kan bevare mad længere og forhindre madspild. Marelli har indgået et samarbejde med andre Boston-baserede forskere for at d
MIT opstart pakker mad ind i silke for bedre holdbarhedEn spiselig silkebaseret belægning udviklet af MIT-adjunkt Benedetto Marelli kan bevare mad længere og forhindre madspild. Marelli har indgået et samarbejde med andre Boston-baserede forskere for at d -
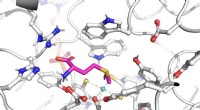 Små forskelle i aminosyrer kan føre til dramatisk forskellige enzymerKredit:University of Queensland Blot nogle få ændringer af et enzyms aminosyrer kan være nok til dramatisk at ændre dets funktion, gør det muligt for mikrober at leve i vildt forskellige miljøer.
Små forskelle i aminosyrer kan føre til dramatisk forskellige enzymerKredit:University of Queensland Blot nogle få ændringer af et enzyms aminosyrer kan være nok til dramatisk at ændre dets funktion, gør det muligt for mikrober at leve i vildt forskellige miljøer. -
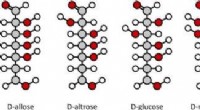 At knække sukkerkoden - hvorfor glykomet er den næste store ting inden for sundhed og medicinKredit:molekuul_be/shutterstock.com Når du tænker på sukker, du tænker sikkert på det søde, hvid, krystallinsk bordsukker, som du bruger til at lave småkager eller søde din kaffe. Men vidste du, a
At knække sukkerkoden - hvorfor glykomet er den næste store ting inden for sundhed og medicinKredit:molekuul_be/shutterstock.com Når du tænker på sukker, du tænker sikkert på det søde, hvid, krystallinsk bordsukker, som du bruger til at lave småkager eller søde din kaffe. Men vidste du, a -
 Enheden kunne høre sygdom gennem strukturer, der huser cellerEn enhed bruger lydbølger til at detektere stivheden af en ekstracellulær matrix, et strukturelt netværk, der indeholder celler. Ændringer i stivheden af denne struktur kan indikere spredning af s
Enheden kunne høre sygdom gennem strukturer, der huser cellerEn enhed bruger lydbølger til at detektere stivheden af en ekstracellulær matrix, et strukturelt netværk, der indeholder celler. Ændringer i stivheden af denne struktur kan indikere spredning af s
- Sådan narre elektroner til at se krystallers skjulte ansigt
- Apotek dropboxes kan hjælpe med at forbedre korrekt bortskaffelse af medicin, undersøgelse finder
- Papirer udforsker massive planktonopblomstringer med meget forskellige økosystempåvirkninger
- Hvad er den bedste måde at lære børn et andetsprog på? Ny forskning giver overraskende resultate…
- Fakta om termitter
- Verdens dødeligste opfinder:Mikhail Kalashnikov og hans AK-47


