Hvilken masse saccharose skal kombineres med 472 vand for at få en opløsning til et osmotisk tryk på 8,95 ved 300?
$$\pi =MRT$$
hvor:
- \(\pi\) er det osmotiske tryk i atmosfærer (atm)
- M er opløsningens molaritet i mol pr. liter (mol/L)
- R er den ideelle gaskonstant (0,08206 L atm/mol K)
- T er den absolutte temperatur i Kelvin (K)
Vi kan bruge denne ligning til at beregne molariteten af den saccharoseopløsning, der kræves for at opnå et osmotisk tryk på 8,95 atm ved 300 K.
$$M =\frac{\pi}{RT} =\frac{8,95 atm}{(0,08206 L atm/mol K)(300 K)}$$
$$M =0,375 mol/L$$
Vi skal derefter beregne massen af saccharose, der kræves for at lave 472 ml af en 0,375 mol/L opløsning.
$$masse =mol \ gange molær masse$$
Den molære masse af saccharose er 342,3 g/mol.
$$masse =0,375 mol/L \ gange 472 mL \ gange \frac{1 L}{1000 mL} \ gange 342,3 g/mol$$
$$masse =59,8 g$$
Derfor bør 59,8 g saccharose kombineres med 472 ml vand for at lave en opløsning med et osmotisk tryk på 8,95 atm ved 300 K.
 Varme artikler
Varme artikler
-
 Undgå bobleproblemer:Undersøgelse af forholdet mellem bobler og elektrokemiFigur 1. Dannelse af bobler på overfladen af en elektrode. Kredit:University of Twente Bobler er kendt for at påvirke energi og masseoverførsel i gasudviklende elektroder. Mange elektrokemiske r
Undgå bobleproblemer:Undersøgelse af forholdet mellem bobler og elektrokemiFigur 1. Dannelse af bobler på overfladen af en elektrode. Kredit:University of Twente Bobler er kendt for at påvirke energi og masseoverførsel i gasudviklende elektroder. Mange elektrokemiske r -
 Grøn metode kunne gøre det muligt for hospitaler at producere brintoverilte i husetForskernes H-celle setup til udvikling af deres hydrogenperoxidproduktionsmetode. Kredit:University of California - San Diego Et team af forskere har udviklet en bærbar, mere miljøvenlig metode ti
Grøn metode kunne gøre det muligt for hospitaler at producere brintoverilte i husetForskernes H-celle setup til udvikling af deres hydrogenperoxidproduktionsmetode. Kredit:University of California - San Diego Et team af forskere har udviklet en bærbar, mere miljøvenlig metode ti -
 Rammediversitet af carbonnitrider tilbyder rig platform for enkeltatoms katalyseOptimerede Pd-koordinationssteder inden for forskellige kulnitridstilladser med 6N, 9N, og 15N lommer. Værdier i parentes under hvert billede angiver de tilsvarende formationsenergier (venstre), bereg
Rammediversitet af carbonnitrider tilbyder rig platform for enkeltatoms katalyseOptimerede Pd-koordinationssteder inden for forskellige kulnitridstilladser med 6N, 9N, og 15N lommer. Værdier i parentes under hvert billede angiver de tilsvarende formationsenergier (venstre), bereg -
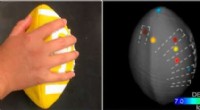 Robotics tager massespecifikationer til den tredje dimension for retsmedicin, farma applikationerVed at kombinere en robotarm og massespektrometri, forskere kan analysere overfladen af 3D-objekter, såsom fodbolde. Kredit:American Chemical Society Inden for det seneste årti, der er gjort man
Robotics tager massespecifikationer til den tredje dimension for retsmedicin, farma applikationerVed at kombinere en robotarm og massespektrometri, forskere kan analysere overfladen af 3D-objekter, såsom fodbolde. Kredit:American Chemical Society Inden for det seneste årti, der er gjort man
- Varmeledende krystaller kan hjælpe computerchips med at holde sig kølige
- Hvorfor ofre for vold i hjemmet ikke rejser:Fire eksperter forklarer
- Vestlig snestorm tiltrækker skiløbere, men efterlader dødelige forhold
- Forskere udvikler en ny metode til at kvantificere usynlig plast i floder
- Abiotiske faktorer i et akvatisk økosystem
- Hvordan Jorden ændrer sig på tværs af forskellige økosystemer


