Hvad er de fire typer kemiske bindinger?
1. Kovalente bindinger opstår, når to eller flere atomer deler elektroner for at danne en stabil elektronkonfiguration. Dette er den stærkeste type kemisk binding og findes i molekyler som vand (H2O) og metan (CH4).
2. Ionbindinger opstår, når en eller flere elektroner overføres fra et atom til et andet, hvilket skaber modsat ladede ioner. Denne type binding findes i forbindelser som natriumchlorid (NaCl) og kaliumiodid (KI).
3. Brintbindinger opstår, når et hydrogenatom bundet til et stærkt elektronegativt atom (såsom nitrogen, oxygen eller fluor) danner en dipol med et andet elektronegativt atom. Denne type binding findes i vandmolekyler og i mange biologiske molekyler såsom proteiner og DNA.
4. Metalbindinger opstår, når metalatomernes yderste elektroner delokaliseres og deles mellem alle atomerne i metallet. Denne type binding findes i metaller som kobber, jern og aluminium.
5. van der Waals obligationer opstår, når der er en svag tiltrækning mellem to eller flere molekyler eller atomer. Denne type binding findes i gasser som helium (He) og argon (Ar) samt i nogle faste stoffer som grafit. Van der Waals-bindinger er den svageste type kemisk binding og brydes let.
Sidste artikelHvilken type kemisk binding danner aluminium?
Næste artikelHvilke typer bindinger danner aktinider?
 Varme artikler
Varme artikler
-
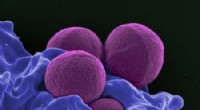 Simpel metode måler, hvor længe bakterier kan vente på antibiotikaEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Et stigende antal patogener udvikler resistens over for et eller flere antibiotika, truer
Simpel metode måler, hvor længe bakterier kan vente på antibiotikaEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Et stigende antal patogener udvikler resistens over for et eller flere antibiotika, truer -
 Forskere har bevist, at ozon er effektivt til at desinficere coronavirusAnbring dråber af virussuspension på sterile overflader før eksponering for ozon. Kredit:Tel Aviv Universitet Undersøgelser har vist, at SARS-CoV-2 forbliver aktiv på aerosoler og overflader i mel
Forskere har bevist, at ozon er effektivt til at desinficere coronavirusAnbring dråber af virussuspension på sterile overflader før eksponering for ozon. Kredit:Tel Aviv Universitet Undersøgelser har vist, at SARS-CoV-2 forbliver aktiv på aerosoler og overflader i mel -
 En ny katalysator til vandspaltning, der er det bedste fra begge verdenerKredit:American Chemical Society At tage vand og rive det fra hinanden til brint og ilt kan danne grundlaget for kunstige fotosyntetiske enheder, der i sidste ende kan drive hjem og virksomheder.
En ny katalysator til vandspaltning, der er det bedste fra begge verdenerKredit:American Chemical Society At tage vand og rive det fra hinanden til brint og ilt kan danne grundlaget for kunstige fotosyntetiske enheder, der i sidste ende kan drive hjem og virksomheder. -
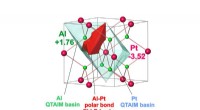 En elektrokatalysator til iltudviklingsreaktion ved vandspaltningAtomic QTAIM-bassiner af platin og aluminium (gennemsigtig) og Al-Pt-bindingsbassin (rød) i Al2Pt-forbindelsen, afslører den udtalte ladningsoverførsel fra Al- til Pt-atomer og polær karakter af Al-Pt
En elektrokatalysator til iltudviklingsreaktion ved vandspaltningAtomic QTAIM-bassiner af platin og aluminium (gennemsigtig) og Al-Pt-bindingsbassin (rød) i Al2Pt-forbindelsen, afslører den udtalte ladningsoverførsel fra Al- til Pt-atomer og polær karakter af Al-Pt
- Hvad er en selvballasteret lampe?
- Værktøjer Brugt i Sand Casting
- Trans-Himalaya-landet Upper Mustang i Nepal kan stå over for alvorlig fødevareusikkerhed
- Ville folk være villige til at give deres personlige data til forskning?
- Forskerteam, der optimerer strålingsdetektering ved hjælp af drone -netværk
- I løbet af hvad overføres elektroner og frigives energi?


