Kan natrium og kviksølv eksistere i monoatomisk molekyledamptilstand?
Natrium (Na) og kviksølv (Hg) er begge grundstoffer, der tilhører forskellige grupper i det periodiske system. Natrium er et alkalimetal, mens kviksølv er et overgangsmetal.
Alkalimetaller, herunder natrium, har en stærk tendens til at miste deres yderste elektron og danne positive ioner (kationer). Dette skyldes, at de har en lav ioniseringsenergi og en stor atomradius. Som et resultat reagerer natriumatomer let med andre grundstoffer for at danne ioniske forbindelser. I sin elementære tilstand eksisterer natrium som et blødt, sølvhvidt metal, der er meget reaktivt og let oxideres.
På den anden side har overgangsmetaller som kviksølv en tendens til at danne kovalente bindinger ved at dele elektroner med andre atomer. Kviksølvatomer har en relativt høj ioniseringsenergi og en mindre atomradius sammenlignet med alkalimetaller. Dette gør dem mindre tilbøjelige til at miste elektroner og danne positive ioner. Merkurs valenselektroner tiltrækkes stærkere af kernen, hvilket resulterer i en højere ioniseringsenergi og en mere kompakt atomstruktur.
På grund af disse forskelle i deres elektroniske konfigurationer og kemiske egenskaber danner natrium og kviksølv ikke monoatomiske molekyledampe. I deres elementære tilstande eksisterer natrium som et fast metal, mens kviksølv er et flydende metal ved stuetemperatur. De har tendens til at danne forskellige typer forbindelser og danner ikke let stabile monoatomiske molekyler i dampfasen.
Sidste artikelHvordan skabes additive farver?
Næste artikelHvad er formålet med en inhibitor i en kemisk reaktion?
 Varme artikler
Varme artikler
-
 Pandemisk forebyggelse i lufthavneIsabel Steppert, videnskabsmand ved Fraunhofer IZI, under prøvemåling. Kredit:Fraunhofer IZI Globale flyrejser er ikke begrænset til mennesker og varer - smitsomme agenter, også, kan lægge vejen o
Pandemisk forebyggelse i lufthavneIsabel Steppert, videnskabsmand ved Fraunhofer IZI, under prøvemåling. Kredit:Fraunhofer IZI Globale flyrejser er ikke begrænset til mennesker og varer - smitsomme agenter, også, kan lægge vejen o -
 Lab gør 4-D print mere praktiskFormskiftende materialer produceret på Rice University med en 3D-printermorph fra deres oprindelige form til en alternativ gennem ændringer i temperatur, elektrisk strøm eller stress. Dette eksempel v
Lab gør 4-D print mere praktiskFormskiftende materialer produceret på Rice University med en 3D-printermorph fra deres oprindelige form til en alternativ gennem ændringer i temperatur, elektrisk strøm eller stress. Dette eksempel v -
 Team opnår to-elektron kemiske reaktioner ved hjælp af lysenergi, guldUnder de rette forhold, guld nanopartikler absorberer lys og overfører elektroner til andre reaktanter. Denne proces kan bruges til at omdanne CO2 og vand til kulbrinter. I grafikken, kulstofatomer er
Team opnår to-elektron kemiske reaktioner ved hjælp af lysenergi, guldUnder de rette forhold, guld nanopartikler absorberer lys og overfører elektroner til andre reaktanter. Denne proces kan bruges til at omdanne CO2 og vand til kulbrinter. I grafikken, kulstofatomer er -
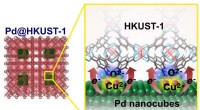 Grænseflade elektronisk tilstand, der forbedrer brintlagringskapacitet i Pd-MOF-materialer(Venstre) Struktur af en Pd@HKUST-1. (Højre) Skematisk diagram, der illustrerer overførslen af elektrisk ladning fra en Pd nanocube til HKUST-1 MOFer (metal-organiske rammer) Kredit:NIMS NIMS, K
Grænseflade elektronisk tilstand, der forbedrer brintlagringskapacitet i Pd-MOF-materialer(Venstre) Struktur af en Pd@HKUST-1. (Højre) Skematisk diagram, der illustrerer overførslen af elektrisk ladning fra en Pd nanocube til HKUST-1 MOFer (metal-organiske rammer) Kredit:NIMS NIMS, K
- Søg efter sterile neutrinoer:Det handler om en bøjning i kurven
- Hvad fejler den nye Jurassic Park-film:Aerodynamisk analyse forårsager en genovervejelse af den stø…
- Et computersystem, der analyserer kemisk affald og foreslår måder at fremstille nye produkter af d…
- FNs fødevareagentur opfordrer agroøkologi til at bekæmpe hungersnød
- Tyske forskere finder ud af, hvordan pilsner først udviklede sig i Bayern
- En handling fra Gud, eller bare dårlig ledelse? Hvorfor træer falder, og hvordan man forhindrer de…


