Hvad er nogle af egenskaberne ved kovalente krystaller?
1. Stærke bånd: Kovalente krystaller har stærke kovalente bindinger mellem atomerne, hvilket resulterer i en stiv og veldefineret struktur. De kovalente bindinger dannes ved deling af elektroner mellem atomer.
2. Høje smelte- og kogepunkter: Kovalente krystaller har relativt høje smelte- og kogepunkter på grund af de stærke interatomiske kræfter. De stærke kovalente bindinger kræver en betydelig mængde energi for at bryde, hvilket resulterer i højere smelte- og kogepunkter.
3. Isolatorer: Kovalente krystaller er generelt dårlige ledere af elektricitet og er klassificeret som isolatorer. Elektronerne i kovalente krystaller er stærkt lokaliseret i de kovalente bindinger mellem atomer, og der er ingen frie elektroner til rådighed til at bære elektrisk strøm.
4. Hårdhed: Kovalente krystaller kan være hårde og modstandsdygtige over for deformation, da de stærke kovalente bindinger forhindrer atomerne i at bevæge sig let forbi hinanden. Eksempler omfatter diamant (kovalent netværk fast stof) og grafit (kovalent pladefast stof).
5. Opløselighed: Kovalente krystaller er typisk uopløselige i vand og andre polære opløsningsmidler på grund af deres upolære natur. De kovalente bindinger mellem atomer er upolære, så de interagerer ikke godt med polære opløsningsmidler.
6. Lav elektrisk ledningsevne: Som tidligere nævnt er kovalente krystaller dårlige ledere af elektricitet på grund af manglen på frie elektroner. De tæt bundne elektroner i kovalente bindinger forhindrer bevægelse af ladninger.
7. Lav termisk ledningsevne: Kovalente krystaller har lav varmeledningsevne, hvilket betyder, at de er dårlige varmeledere. De stærke kovalente bindinger og stive struktur hindrer overførsel af varme gennem vibrationer.
8. Reaktivitet: Kovalente krystaller har generelt lavere reaktivitet sammenlignet med ioniske krystaller. De gennemgår ikke uden videre kemiske reaktioner, fordi de stærke kovalente bindinger mellem atomer er stabile og kræver høj aktiveringsenergi for at bryde.
9. Glimrende udseende: Mange kovalente krystaller udviser et skinnende eller skinnende udseende på grund af det regelmæssige arrangement af atomer og refleksion af lys fra deres glatte overflader.
10. Spaltning: Kovalente krystaller udviser ofte spaltningsplaner, hvor krystallen kan spaltes langs specifikke svaghedsplaner. Disse svaghedsplaner opstår, når de kovalente bindinger er svagere i visse retninger.
Sidste artikelHvad er farven på methylorange i alkali?
Næste artikelHvilket grundstof ville danne kovalente bindinger med svovl?
 Varme artikler
Varme artikler
-
 Håndholdte DNA-sekventører viser løfte om overvågning af mikrober under fødevareproduktionKredit:CC0 Public Domain Håndholdte enheder er velegnede til miljøovervågning under fødevareproduktion, og har nøglefordele med hensyn til brugervenlighed og ved at identificere en bred vifte af b
Håndholdte DNA-sekventører viser løfte om overvågning af mikrober under fødevareproduktionKredit:CC0 Public Domain Håndholdte enheder er velegnede til miljøovervågning under fødevareproduktion, og har nøglefordele med hensyn til brugervenlighed og ved at identificere en bred vifte af b -
 Forskere udvikler en biologisk nedbrydelig legering til knogleimplantater til frakturer, osteoporose…Lederen af Hybrid Nanostructured Materials Laboratory ved NUST MISIS Alexander Komissarov. Kredit:Maria Brodskaya/NUST MISIS Materialeforskere fra NUST MISIS og University of Western Australia h
Forskere udvikler en biologisk nedbrydelig legering til knogleimplantater til frakturer, osteoporose…Lederen af Hybrid Nanostructured Materials Laboratory ved NUST MISIS Alexander Komissarov. Kredit:Maria Brodskaya/NUST MISIS Materialeforskere fra NUST MISIS og University of Western Australia h -
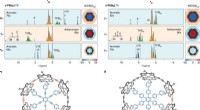 Største rekord for aromatisk ringstørrelse brudt med 162 π elektronerH NMR-spektre af de aromatiske og antiaromatiske seks-porphyrin nanoreringsskabelonkomplekser i oxidationstilstande 2+, 4+ og 6+. Kredit: Naturkemi (2020). DOI:10.1038/s41557-019-0398-3 Et team
Største rekord for aromatisk ringstørrelse brudt med 162 π elektronerH NMR-spektre af de aromatiske og antiaromatiske seks-porphyrin nanoreringsskabelonkomplekser i oxidationstilstande 2+, 4+ og 6+. Kredit: Naturkemi (2020). DOI:10.1038/s41557-019-0398-3 Et team -
 Hurtigere, billigere spildevandsrensning gennem forbedrede oxidationsreaktionerUC Riverside-forskere har vist, at tilføjelse af en billig co-katalysator dramatisk kan forbedre hastigheden og effektiviteten af Advanced Oxidation Processes (AOPer). Kredit:UC Riverside Forske
Hurtigere, billigere spildevandsrensning gennem forbedrede oxidationsreaktionerUC Riverside-forskere har vist, at tilføjelse af en billig co-katalysator dramatisk kan forbedre hastigheden og effektiviteten af Advanced Oxidation Processes (AOPer). Kredit:UC Riverside Forske
- Billig, miljøvenlig katalysator åbner nye muligheder for organiske molekyler bygget af pyruvat
- Forskere giver den mest detaljerede og fuldstændige registrering af Jordens sidste magnetiske vendi…
- Forskere mener, at rovfuglen caracara fortjener en PR-makeover
- Nanobærere kan give nyt håb for hjernekræftbehandling
- Får alle 'en del af den nationale kage'? Hvordan nigerianske politikere samarbejder om at fordele o…
- Sådan finder du asymptoter & Holes


