Hvad er reaktionen for aluminium og oxygen?
4Al(s) + 3O2(g) → 2Al2O3(s)
I denne reaktion reagerer fire mol fast aluminium med tre mol oxygengas for at producere to mol fast aluminiumoxid. Processen involverer overførsel af elektroner fra aluminiumsatomer til oxygenatomer, hvilket fører til dannelsen af stærke ionbindinger i aluminiumoxidforbindelsen.
Under reaktionen frigives en betydelig mængde varme i form af lys og varmeenergi. Denne eksoterme karakter af reaktionen gør den nyttig i forskellige industrielle anvendelser, såsom svejsning og skæring af metaller. Den intense varme, der produceres, kan smelte og smelte metaller sammen, hvilket gør det til et værdifuldt værktøj i metalbearbejdningsprocesser.
Aluminiumoxid, produktet af denne reaktion, er et hvidt, hårdt og ildfast materiale. Det er almindeligvis kendt som aluminiumoxid og finder anvendelse i forskellige industrier, herunder slibemidler, højtemperaturkeramik og som katalysator i kemiske processer.
Sidste artikelHvad gør to primærfarver blandet sammen?
Næste artikelHvordan kan temperaturen i autoklaven komme over kogepunktet på 212 F?
 Varme artikler
Varme artikler
-
 Brug af elektricitet til at give kemi et løftUD-forskere har udviklet en ny metode til fremstilling af jernbaserede metalorganiske rammer (MOF) materialer. På billedet:Kandidatstuderende Amanda Weaver (til venstre) sætter gang i den UD-udviklede
Brug af elektricitet til at give kemi et løftUD-forskere har udviklet en ny metode til fremstilling af jernbaserede metalorganiske rammer (MOF) materialer. På billedet:Kandidatstuderende Amanda Weaver (til venstre) sætter gang i den UD-udviklede -
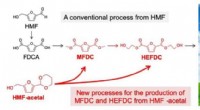 Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli
Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli -
 Ny teknologi forbedrer brintproduktionenINL-forskere demonstrerede højtydende elektrokemisk brintproduktion ved en lavere temperatur, end det havde været muligt før. Kredit:Idaho National Laboratory Industrielt brint er tættere på at bl
Ny teknologi forbedrer brintproduktionenINL-forskere demonstrerede højtydende elektrokemisk brintproduktion ved en lavere temperatur, end det havde været muligt før. Kredit:Idaho National Laboratory Industrielt brint er tættere på at bl -
 Ny test identificerer hurtigt antibiotikaresistente superbugsTara deBoer rummer en brøndtallerken med syntetiske urinprøver, der er føjet til DETECT-opløsningen. Opløsningen bliver gul, når der er antibiotikaresistente bakterier til stede. Kredit:Stephen McNall
Ny test identificerer hurtigt antibiotikaresistente superbugsTara deBoer rummer en brøndtallerken med syntetiske urinprøver, der er føjet til DETECT-opløsningen. Opløsningen bliver gul, når der er antibiotikaresistente bakterier til stede. Kredit:Stephen McNall
- Et blomstrende elbilsalg driver lithiumrush i Portugal
- Aqua Satellite zoomer ind i Super Typhoon Marias lille øje
- Opdagelsen af neutronstjernekollision er et gennembrud i 2017
- Kina lancerer et af 2 laboratoriemoduler for at slutte sig til rumstationen
- Sådan sammenligner du størrelsen af et Atom
- Israelsk hold vurderer, hvad der gik galt med månelandingen


