Hvordan kan temperaturen i autoklaven komme over kogepunktet på 212 F?
Når trykket stiger, stiger vands kogepunkt også. Det skyldes, at højere tryk forhindrer vandmolekylerne i at slippe ud i luften som damp, så de skal nå en højere temperatur for at have energi nok til at overvinde det øgede tryk.
For eksempel, ved et tryk på 15 pund pr. kvadrattomme (psi), er kogepunktet for vand ca. 250°F (121°C). Dette er standardtrykket, der bruges i de fleste autoklaver til sterilisering af laboratorieudstyr og medicinske instrumenter. Ved et tryk på 30 psi er kogepunktet for vand omkring 275°F (135°C).
Da vand ikke kan ændre sin tilstand i et forseglet miljø, før temperaturen er opnået for at overvinde det eksisterende tryk indeni, vil temperaturen fortsætte med at stige for at tilfredsstille den energi, der kræves for at skifte til gasformig tilstand.
 Varme artikler
Varme artikler
-
 Færdiggørelse af lægemiddeldesignstikksavenKredit:University of East Anglia En kraftfuld ny måde at analysere, hvordan lægemidler interagerer med molekyler i kroppen, kan hjælpe med at designe bedre behandlinger med færre bivirkninger. De
Færdiggørelse af lægemiddeldesignstikksavenKredit:University of East Anglia En kraftfuld ny måde at analysere, hvordan lægemidler interagerer med molekyler i kroppen, kan hjælpe med at designe bedre behandlinger med færre bivirkninger. De -
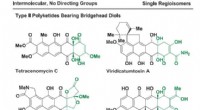 Metalkatalyseret tilsætning af mættet kulstof til C-C bindinger:En relevant reaktion for syntese t…Ruthenium-katalyseret cyclobutenon-diol [4+2]cycloaddition via C-C bindingsaktivering:En gateway til type II polyketid naturlige produkter. Kredit:(c) Videnskab (2017). DOI:10.1126/science.aao0453
Metalkatalyseret tilsætning af mættet kulstof til C-C bindinger:En relevant reaktion for syntese t…Ruthenium-katalyseret cyclobutenon-diol [4+2]cycloaddition via C-C bindingsaktivering:En gateway til type II polyketid naturlige produkter. Kredit:(c) Videnskab (2017). DOI:10.1126/science.aao0453 -
 En tungvægtsløsning til lettere kampkøretøjerFriction Stir Dovetailing er en proces, der forbinder tykke plader af aluminium til stål. Den nye proces vil blive brugt til at lave lettere militærkøretøjer, der er mere adrætte og brændstofeffektive
En tungvægtsløsning til lettere kampkøretøjerFriction Stir Dovetailing er en proces, der forbinder tykke plader af aluminium til stål. Den nye proces vil blive brugt til at lave lettere militærkøretøjer, der er mere adrætte og brændstofeffektive -
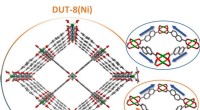 Ny indsigt i omskiftelige MOF-strukturerSe ind i en MOF-krystal eksemplificeret ved DUT-8. De massive porer kan tydeligt mærkes. Kredit:TU Dresden Metal-organiske rammeforbindelser (MOFer) består af uorganiske og organiske grupper og er
Ny indsigt i omskiftelige MOF-strukturerSe ind i en MOF-krystal eksemplificeret ved DUT-8. De massive porer kan tydeligt mærkes. Kredit:TU Dresden Metal-organiske rammeforbindelser (MOFer) består af uorganiske og organiske grupper og er
- Ny undervands geolokaliseringsteknik tager udgangspunkt i naturen
- Global handel med soja har store konsekvenser for klimaet
- Opvarmet bugt ud for Sveriges kyst viser potentielt, hvordan økosystemer påvirkes af fremtidens gl…
- NASA spejler på ESA pathfinder for at forbedre månenavigationen
- Tumorsuppressorprotein spiller en central rolle i at undertrykke infektioner
- Forskere tager et dybt dyk ned i, hvordan hajer bruger havet


