Hvilke egenskaber har Arrhenius-syrer til fælles?
- Syrlig smag:Arrhenius-syrer har en sur smag, såsom smagen af citronsaft eller eddike.
- Reagere med metaller:Arrhenius-syrer reagerer med metaller for at producere brintgas. For eksempel, når saltsyre (HCl) tilsættes til jern (Fe), producerer det hydrogengas (H2) og jern(II)chlorid (FeCl2).
- Reagere med baser:Arrhenius-syrer reagerer med baser og producerer salt og vand. For eksempel, når saltsyre (HCl) tilsættes til natriumhydroxid (NaOH), producerer det natriumchlorid (NaCl) og vand (H2O).
- Skift farve på indikatorer:Arrhenius-syrer ændrer farven på visse indikatorer, såsom lakmuspapir eller phenolphtalein. For eksempel bliver lakmuspapir rødt, når det dyppes i en sur opløsning.
- Elektrisk ledningsevne:Arrhenius-syrer leder elektricitet, når de opløses i vand. Dette skyldes, at de H+ ioner, der frigives af syren, kan bevæge sig frit i vandet og bærer en elektrisk ladning.
Det er vigtigt at bemærke, at Arrhenius-syrer er et ældre begreb i kemi. Moderne teorier om syrer og baser (såsom Bronsted-Lowry-teorien eller Lewis-teorien) giver en mere fuldstændig forståelse af sur adfærd ud over begrebet brintionfrigivelse.
Sidste artikelEr kobberacetat en svag base?
Næste artikelHvordan putter man klor i en pool?
 Varme artikler
Varme artikler
-
 Ny klasse af materialer kunne bruges til at lave batterier, der oplades hurtigereKredit:CC0 Public Domain Forskere har identificeret en gruppe materialer, der kunne bruges til at lave batterier med endnu højere effekt. Forskerne, fra University of Cambridge, brugte materialer
Ny klasse af materialer kunne bruges til at lave batterier, der oplades hurtigereKredit:CC0 Public Domain Forskere har identificeret en gruppe materialer, der kunne bruges til at lave batterier med endnu højere effekt. Forskerne, fra University of Cambridge, brugte materialer -
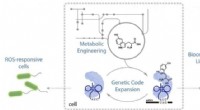 Kemikere udvider den genetiske kode for E. coli til at producere den 21. aminosyre, giver det nye ev…Forskere fra Rice University introducerede ikke -kanoniske aminosyre byggesten i proteiner i levende celler, banebrydende et kraftfuldt værktøj til at undersøge og manipulere proteiners struktur og fu
Kemikere udvider den genetiske kode for E. coli til at producere den 21. aminosyre, giver det nye ev…Forskere fra Rice University introducerede ikke -kanoniske aminosyre byggesten i proteiner i levende celler, banebrydende et kraftfuldt værktøj til at undersøge og manipulere proteiners struktur og fu -
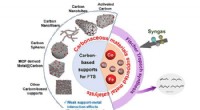 Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg
Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg -
 Smarte fluorescerende molekylære switches baseret på borbaserede forbindelserDenne visualisering viser lag af grafen, der bruges til membraner. Kredit:University of Manchester En molekylær switch er et molekyle, der reversibelt kan skiftes mellem to eller flere stabile til
Smarte fluorescerende molekylære switches baseret på borbaserede forbindelserDenne visualisering viser lag af grafen, der bruges til membraner. Kredit:University of Manchester En molekylær switch er et molekyle, der reversibelt kan skiftes mellem to eller flere stabile til
- Nanopartikler kan øge effektiviteten og reducere bivirkninger af allergisprøjter
- Ny undersøgelse undersøger, hvordan bakterier opnår immunitet
- Undersøgelse:Nordvestlig hedebølge umulig uden klimaændringer
- Etiopisk besætning fulgte proceduren, men ude af stand til at kontrollere jet:forespørgsel
- Hvad er den største ulempe ved brugen af atomkraft?
- Diamanter fundet med guld i Canadas Far North giver ledetråde til Jordens tidlige historie


