40,00 ml 0,10 M HC2H3O2 titreres med 0,15 NaOH. Ka 1,8x10-5 Hvilket volumen NaOH brugte til at nå ækvivalens pt og hvilken molær koncentration C2H3O2- pt?
HC2H3O2 + NaOH -> NaC2H3O2 + H2O
Ved ækvivalenspunktet vil al HC2H3O2 have reageret med NaOH for at danne NaC2H3O2. Derfor vil antallet af mol NaOH, der anvendes ved ækvivalenspunktet, være lig med antallet af mol HC2H3O2, der oprindeligt er til stede.
Antallet af mol HC2H3O2, der oprindeligt er til stede, er:
$$0,10 \text{ M} \times 0,040 \text{ L} =4,0 \times 10^{-3} \text{ mol}$$
Derfor er antallet af mol NaOH anvendt ved ækvivalenspunktet også 4,0 x 10-3 mol.
Volumenet af NaOH anvendt ved ækvivalenspunktet kan beregnes ved hjælp af følgende formel:
$$V =\frac{n}{C}$$
hvor:
* V er volumen i liter
* n er antallet af mol
* C er koncentrationen i mol pr. liter
Ved at erstatte de værdier, vi kender i formlen, får vi:
$$V =\frac{4.0 \times 10^{-3} \text{ mol}}{0.15 \text{ M}}$$
=0,0267 L
Derfor er volumenet af NaOH, der bruges til at nå ækvivalenspunktet, 0,0267 L eller 26,7 ml.
Ved ækvivalenspunktet kan koncentrationen af C2H3O2- beregnes ved hjælp af følgende formel:
$$[C2H3O2-] =\frac{n}{V}$$
hvor:
* [C2H3O2-] er koncentrationen af C2H3O2- i mol pr. liter
* n er antallet af mol C2H3O2-
* V er volumen i liter
Ved ækvivalenspunktet er antallet af mol C2H3O2- lig med antallet af mol HC2H3O2, der oprindeligt er til stede, hvilket er 4,0 x 10-3 mol. Volumenet ved ækvivalenspunktet er summen af de anvendte volumener af HC2H3O2 og NaOH, hvilket er 40,00 ml + 26,7 ml =66,7 ml eller 0,0667 L.
Ved at erstatte disse værdier i formlen får vi:
$$[C2H3O2-] =\frac{4,0 \times 10^{-3} \text{ mol}}{0,0667 \text{ L}}$$
=0,0600 M
Derfor er koncentrationen af C2H3O2- ved ækvivalenspunktet 0,0600 M.
Sidste artikelOpløser carbolsyre hvert mineral?
Næste artikelHvad er ren wolfram?
 Varme artikler
Varme artikler
-
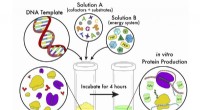 Forenklet metode gør cellefri proteinsyntese mere fleksibel og tilgængeligEn tegneserie af cellefri proteinsyntese, en bioteknologi, der udnytter cellens genetiske kode i et reagensglas. Skematikken repræsenterer en forenklet tilgang, der gør det muligt for forskere at udfø
Forenklet metode gør cellefri proteinsyntese mere fleksibel og tilgængeligEn tegneserie af cellefri proteinsyntese, en bioteknologi, der udnytter cellens genetiske kode i et reagensglas. Skematikken repræsenterer en forenklet tilgang, der gør det muligt for forskere at udfø -
 Ny smart polymer lyser klarere, når den strækkesTil venstre er to film af polymeren, med kobberkomplekserne inkorporeret som tværbindere. Til højre er to hætteglas med de isolerede kobberkomplekser, som blev udviklet af Pradyna Patil, tidligere pos
Ny smart polymer lyser klarere, når den strækkesTil venstre er to film af polymeren, med kobberkomplekserne inkorporeret som tværbindere. Til højre er to hætteglas med de isolerede kobberkomplekser, som blev udviklet af Pradyna Patil, tidligere pos -
 Produktionsteknologi for nye flystrukturer har øget deres styrke3D-printede kompositdele. Kredit:Sergey Gnuskov/NUST MISIS Forskere fra NUST MISIS har udviklet en metode til fremstilling af kompositdele til luftfartsindustrien, som har øget styrken af færdige
Produktionsteknologi for nye flystrukturer har øget deres styrke3D-printede kompositdele. Kredit:Sergey Gnuskov/NUST MISIS Forskere fra NUST MISIS har udviklet en metode til fremstilling af kompositdele til luftfartsindustrien, som har øget styrken af færdige -
 Fra nata de coco til computerskærme:Cellulose får en chance for at skinneKontrol af optisk retardering af den justerede cellulosefilm. Kredit:Osaka University Et hold ved Institute of Scientific and Industrial Research ved Osaka University har bestemt de optiske parame
Fra nata de coco til computerskærme:Cellulose får en chance for at skinneKontrol af optisk retardering af den justerede cellulosefilm. Kredit:Osaka University Et hold ved Institute of Scientific and Industrial Research ved Osaka University har bestemt de optiske parame
- Hvordan kunne tilsætning af kalk til havvand reducere atmosfærisk CO2?
- USA i dybfrysning, mens meget af verden er ekstra toasty? Endnu en gang er det klimaforandringer
- Syntetiske beklædningsfibre bidrager med store mængder plastikforurening på land
- Hvorfor bæverlignende dæmninger kan beskytte samfund mod oversvømmelser
- Billedbehandlingsteknik giver katalytisk 2-D materialeteknik et bedre udsyn
- Billedsystemer til at hjælpe biblioteker og museer med at afdække tabte tekster


