Hvordan binder bor sig til jod?
Bor og jod kan udover enkeltbindingen også danne dobbeltbindinger, hvor to elektronpar er delt mellem de to atomer. Denne type binding er mindre almindelig, og den opstår, når boratomets tre valenselektroner deles med jodatomets fem valenselektroner. Det resulterende molekyle har en molekylformel på BI2.
Styrken af bindingen mellem bor og jod afhænger af antallet af delte elektronpar. Enkeltbindingen er svagere end dobbeltbindingen, fordi der er mindre elektrontæthed mellem de to atomer. Det betyder, at enkeltbindingen er mere tilbøjelig til at bryde fra hinanden end dobbeltbindingen.
Bindingen mellem bor og jod påvirkes også af de to atomers elektronegativitet. Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner. Bor er mindre elektronegativt end jod, hvilket betyder, at jod har en stærkere tiltrækning af elektroner end bor. Denne forskel i elektronegativitet kan få elektronerne i bindingen til at blive trukket mod jodatomet, hvilket skaber en delvis negativ ladning på jodatomet og en delvis positiv ladning på boratomet. Denne polaritet kan svække bindingen mellem de to atomer.
Samlet set er bindingen mellem bor og jod en kovalent binding, der kan være enten en enkeltbinding eller en dobbeltbinding. Styrken af bindingen afhænger af antallet af delte elektronpar og elektronegativiteten af de to atomer.
 Varme artikler
Varme artikler
-
 Et molekyle, der fungerer som et nanobatteriHPC-klyngen CARL hjalp med at dechifrere molekylets adfærd gennem omfattende beregninger. Kredit:Daniel Schmidt/University of Oldenburg Hvordan fungerer molekylære katalysatorer - molekyler, som s
Et molekyle, der fungerer som et nanobatteriHPC-klyngen CARL hjalp med at dechifrere molekylets adfærd gennem omfattende beregninger. Kredit:Daniel Schmidt/University of Oldenburg Hvordan fungerer molekylære katalysatorer - molekyler, som s -
 Neutronmicellemålinger giver indsigt i forbedret lægemiddelleveringTyler Cooksey, en kandidatforsker ved University of Houston, bruger ORNLs Bio-SANS-instrument ved High Flux Isotope Reactor til at forstå, hvordan miceller kan forbedres for at skabe mere effektive læ
Neutronmicellemålinger giver indsigt i forbedret lægemiddelleveringTyler Cooksey, en kandidatforsker ved University of Houston, bruger ORNLs Bio-SANS-instrument ved High Flux Isotope Reactor til at forstå, hvordan miceller kan forbedres for at skabe mere effektive læ -
 Et bedre bæredygtigt hygiejnebindSHERO Pad, udviklet af et team af University of Utah materialevidenskab og ingeniørstuderende, er en ny feminin hygiejnepude, der er 100 procent biologisk nedbrydelig og lavet af alle naturlige materi
Et bedre bæredygtigt hygiejnebindSHERO Pad, udviklet af et team af University of Utah materialevidenskab og ingeniørstuderende, er en ny feminin hygiejnepude, der er 100 procent biologisk nedbrydelig og lavet af alle naturlige materi -
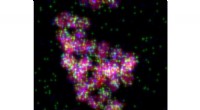 Omgivet af potentiale:Ny videnskab i omdannelse af biomasseTEM-billede af Ce-P-Pd elementærkort. Kredit:Igor Slowing I hver plante - fra træer til afgrøder - findes der et stof, der udgør dens træ eller stængler, fiber, og cellevægge. Dette stof er en kom
Omgivet af potentiale:Ny videnskab i omdannelse af biomasseTEM-billede af Ce-P-Pd elementærkort. Kredit:Igor Slowing I hver plante - fra træer til afgrøder - findes der et stof, der udgør dens træ eller stængler, fiber, og cellevægge. Dette stof er en kom
- Kina ønsker centraliseret digital valuta efter bitcoin-angreb
- Swarm udforsker et nyt træk ved nordlyset
- Det første arabiske sæt til ISS siger, at rejsen vil skrive historie
- Bliver insekter trukket til lys? Ny forskning viser, at det er forvirring, ikke fatal tiltrækning
- Sequoia National Parks Giant Forest uskadt af skovbrand
- Rewilding af dyr med stor krop kan afbøde økosystemets forringelse, viser undersøgelse


