Du opvarmer 3.970 g af en blanding Fe3O4 og FeO for at danne 4.195 Fe2O3. Den reagerede mængde oxygen er?
1. Beregn molerne af Fe3O4 og FeO i den oprindelige blanding:
Den molære masse af Fe3O4 =55,845 g/mol
Mol Fe3O4 =3,970 g / 55,845 g/mol =0,0710 mol
Den molære masse af FeO =71,844 g/mol
Mol FeO =3,970 g - 0,0710 mol * 231,53 g/mol =0,0116 mol
2. Beregn molerne ilt i den oprindelige blanding:
For Fe3O4 er der 4 oxygenatomer pr. molekyle.
Mol oxygen fra Fe3O4 =0,0710 mol * 4 =0,284 mol
For FeO er der 1 oxygenatom pr. molekyle.
Mol oxygen fra FeO =0,0116 mol * 1 =0,0116 mol
Total mol oxygen i den oprindelige blanding =0,284 mol + 0,0116 mol =0,2956 mol
3. Beregn antallet af mol oxygen i slutproduktet, Fe2O3:
Den molære masse af Fe2O3 =159,69 g/mol
Mol Fe2O3 =4,195 g / 159,69 g/mol =0,0263 mol
For Fe2O3 er der 3 oxygenatomer pr. molekyle.
Mol oxygen i Fe2O3 =0,0263 mol * 3 =0,0789 mol
4. Beregn forskellen i mol ilt:
Mol ilt reageret =Mol ilt i startblanding - Mol ilt i slutproduktet
Mol ilt reageret =0,2956 mol - 0,0789 mol =0,2167 mol
5. Beregn massen af reageret ilt:
Den molære masse af oxygen =16 g/mol
Masse af reageret oxygen =0,2167 mol * 16 g/mol =3,467 g
Derfor er massen af ilt, der reagerede, 3,467 g.
Sidste artikelHvad sker der under en reduktion af atom eller molekyle?
Næste artikelHvad er massen af 175 atomer guld?
 Varme artikler
Varme artikler
-
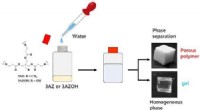 Tilføj bare vand:En simpel metode til at opnå alsidige porøse polymererForskere fra SIT, Japan, opdager, at tilsætning af vand til en triaziridinforbindelse ved milde temperaturer er nok til at producere stærke og konsistente porøse polymerer. Ved at justere reaktionstem
Tilføj bare vand:En simpel metode til at opnå alsidige porøse polymererForskere fra SIT, Japan, opdager, at tilsætning af vand til en triaziridinforbindelse ved milde temperaturer er nok til at producere stærke og konsistente porøse polymerer. Ved at justere reaktionstem -
 At producere gødning fra luft kan være fem gange så effektivtGliding Arc reaktor. Kredit:Eindhoven University of Technology Afrikanske landmænd, der er i stand til at producere deres egen gødning kun ud fra luft. Bhaskar S. Patil bringer denne udsigt tætter
At producere gødning fra luft kan være fem gange så effektivtGliding Arc reaktor. Kredit:Eindhoven University of Technology Afrikanske landmænd, der er i stand til at producere deres egen gødning kun ud fra luft. Bhaskar S. Patil bringer denne udsigt tætter -
 Nedbrydelige sukkerbaserede polymerer kan lagre og frigive nyttig molekylær fragtKredit:CC0 Public Domain Nedbrydeligt, biobaserede polymerer tilbyder muligheder for kemisk genbrug, og de kan være et redskab til at lagre og frigive nyttige molekyler. Forskere har udviklet en k
Nedbrydelige sukkerbaserede polymerer kan lagre og frigive nyttig molekylær fragtKredit:CC0 Public Domain Nedbrydeligt, biobaserede polymerer tilbyder muligheder for kemisk genbrug, og de kan være et redskab til at lagre og frigive nyttige molekyler. Forskere har udviklet en k -
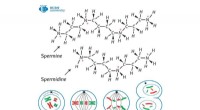 Biokemiker opdager et lovende enzym til at bekæmpe kræftcellerKredit:RUDN Universitet En biokemiker fra RUDN Universitet har undersøgt kemiske stoffers stimulerende virkning på det kataboliske enzym PAO (polyaminoxidase). Resultaterne kan bidrage til udvikli
Biokemiker opdager et lovende enzym til at bekæmpe kræftcellerKredit:RUDN Universitet En biokemiker fra RUDN Universitet har undersøgt kemiske stoffers stimulerende virkning på det kataboliske enzym PAO (polyaminoxidase). Resultaterne kan bidrage til udvikli
- Et nyt spin på atomer giver forskerne et nærmere kig på kvanteunderligheder
- Krydstogtsskibe skal reguleres effektivt for at minimere alvorlig miljø- og sundhedspåvirkning
- Radar udviklet til hurtig redning af begravede mennesker
- Ida:Udråbstegn på rekordstort stormløb af amerikanske landfald
- Forskning viser bevis for jordis på asteroider
- Skiløb, klatring, global opvarmning:Franske alper viser dilemma


