Hvad sker der under en reduktion af atom eller molekyle?
1. Forstærkning af elektroner:Under reduktion accepterer et atom eller et molekyle elektroner fra et andet stof og bliver mere negativt ladet. Elektronerne tilføjes til den yderste elektronskal af atomet eller molekylet, hvilket øger elektrontætheden.
2. Tab af ilt:Reduktion kan også ske gennem fjernelse af ilt fra et molekyle. Når et iltatom fjernes, får molekylet elektroner, hvilket resulterer i en reduktionsproces.
3. Forøgelse af negativ ladning:Som et resultat af at få elektroner eller tabe ilt, øges den samlede negative ladning af atomet eller molekylet. Denne ændring i ladningen påvirker dens kemiske egenskaber og reaktivitet.
4. Fald i oxidationstal:I kemi repræsenterer oxidationstallet den ladning et atom ville have, hvis alle dets bindinger var fuldstændigt ioniske. Under reduktion falder oxidationstallet for atomet eller molekylet. Dette skyldes, at forstærkningen af elektroner eller tabet af ilt resulterer i en mere negativ ladning eller en lavere positiv ladning.
5. Ændring i binding:Reduktion kan føre til ændringer i bindingen af atomet eller molekylet. Tilsætning af elektroner eller fjernelse af ilt kan ændre elektronkonfigurationen og påvirke den måde, atomet eller molekylet interagerer med andre stoffer.
6. Dannelse af nye stoffer:Reduktionsreaktioner resulterer ofte i dannelse af nye stoffer. Det reducerede atom eller molekyle kan gennemgå yderligere reaktioner eller kombineres med andre arter for at danne forskellige produkter.
7. Betydning i biologiske processer:Reduktionsreaktioner spiller en afgørende rolle i forskellige biologiske processer, herunder cellulær respiration, fotosyntese og metaboliske veje. De er afgørende for at opretholde energibalancen og udføre vitale funktioner i levende organismer.
8. Eksempler på reduktion:
- Rustning af jern (Fe) involverer reduktion af oxygen, hvor Fe-atomer får elektroner fra oxygen, hvilket fører til dannelsen af jernoxid (Fe2O3).
- I fotosyntesen bruger planter sollys til at reducere kuldioxid (CO2) ved at få elektroner fra vand (H2O), hvilket resulterer i produktionen af glukose (C6H12O6).
Overordnet set er reduktion en grundlæggende kemisk proces, der involverer forstærkning af elektroner eller tab af ilt, hvilket fører til ændringer i ladning, oxidationstal, binding og dannelse af nye stoffer. Det har adskillige anvendelser inden for kemi, metallurgi og biologiske systemer.
 Varme artikler
Varme artikler
-
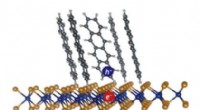 Hurtigt bevægende elektroner skaber strøm i organiske solcellerEn exciton (elektron-hul-par) dannet ved grænsefladen mellem tetracen-molekyler (en organisk halvleder) og enkeltlags WS2 (en uorganisk halvleder). Dissociation af sådanne grænseflade excitoner er nød
Hurtigt bevægende elektroner skaber strøm i organiske solcellerEn exciton (elektron-hul-par) dannet ved grænsefladen mellem tetracen-molekyler (en organisk halvleder) og enkeltlags WS2 (en uorganisk halvleder). Dissociation af sådanne grænseflade excitoner er nød -
 Miljøvenlig plast fra cellulose og vandDen nyproducerede bioplast består af hydroplastiske polymerer, som bliver bløde og formbare ved kontakt med vand. Kredit:K Zhang Plast giver mange fordele for samfundet og bruges meget i vores dag
Miljøvenlig plast fra cellulose og vandDen nyproducerede bioplast består af hydroplastiske polymerer, som bliver bløde og formbare ved kontakt med vand. Kredit:K Zhang Plast giver mange fordele for samfundet og bruges meget i vores dag -
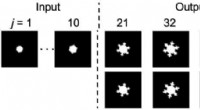 Ny strategi sætter udviklingen af mikroskopiske strukturer i gangIngeniører ved Rice University og Lawrence Livermore National Laboratory bruger neurale netværk til at fremskynde forudsigelsen af, hvordan mikrostrukturer af materialer udvikler sig. Dette eksempel f
Ny strategi sætter udviklingen af mikroskopiske strukturer i gangIngeniører ved Rice University og Lawrence Livermore National Laboratory bruger neurale netværk til at fremskynde forudsigelsen af, hvordan mikrostrukturer af materialer udvikler sig. Dette eksempel f -
 En tungvægtsløsning til lettere kampkøretøjerFriction Stir Dovetailing er en proces, der forbinder tykke plader af aluminium til stål. Den nye proces vil blive brugt til at lave lettere militærkøretøjer, der er mere adrætte og brændstofeffektive
En tungvægtsløsning til lettere kampkøretøjerFriction Stir Dovetailing er en proces, der forbinder tykke plader af aluminium til stål. Den nye proces vil blive brugt til at lave lettere militærkøretøjer, der er mere adrætte og brændstofeffektive
- Fysikere skabte en mikrolaser, der udsender to cirkulære stråler
- Undersøgelse:Ødelæggelse fra havstigningen i Californien kan overstige de værste naturbrande og …
- Forskere opfinder en enhed i møntstørrelse til hurtigt at isolere blodplasma til diagnostik og præ…
- Hvorfor COVID-19 misinformation spredte sig hurtigere end pandemi i begyndelsen af marts
- Træer, de gamle makedonere, og verdens første miljøkatastrofe
- Gamle australske træer står over for en usikker fremtid under klimaændringer, undersøgelse finde…


