Hvad sker der, hvis du tilsætter natriumhydroxidopløsning til noget saltsyre i et bægerglas?
1. Ionisk dissociation:
- Natriumhydroxid (NaOH) er en stærk base, der dissocierer fuldstændigt i vand og danner natrium (Na+) og hydroxid (OH-) ioner.
- Saltsyre (HCl) er en stærk syre, der dissocierer fuldstændigt i vand og danner hydrogen (H+) og klorid (Cl-) ioner.
2. Neutraliseringsreaktion:
- Når de to opløsninger blandes, reagerer hydrogenioner (H+) fra saltsyre med hydroxidioner (OH-) fra natriumhydroxid og danner vandmolekyler (H2O).
- Den overordnede kemiske ligning for neutraliseringsreaktionen er:
NaOH(aq) + HCl(aq) -> NaCl(aq) + H2O(l)
3. Danning af natriumchlorid:
- Efterhånden som reaktionen skrider frem, kombineres natriumioner (Na+) fra natriumhydroxid og chloridioner (Cl-) fra saltsyre og danner natriumchlorid (NaCl), som er et neutralt salt.
- Natriumchlorid opløses i vand og dissocieres til dets respektive ioner.
4. Varmefrigivelse:
- Neutraliseringsreaktionen er eksoterm, hvilket betyder, at den frigiver varme. Den frigivne varme får opløsningstemperaturen til at stige, og reaktionsblandingen kan føles varm at røre ved.
5. pH-ændring:
- Før blanding har natriumhydroxidopløsning en høj pH (basisk) på grund af tilstedeværelsen af hydroxidioner. Saltsyre har en lav pH (sur) på grund af tilstedeværelsen af hydrogenioner.
- Efter neutralisering bliver pH i den resulterende opløsning neutral (pH =7), fordi hydrogenionerne og hydroxidionerne er blevet forbrugt i lige store mængder.
6. Saltdannelse og løsningsledningsevne:
- Det dannede natriumchlorid (NaCl) øger opløsningens ledningsevne. Dette skyldes, at natriumchlorid, ligesom andre salte, dissocieres til ioner i vand, hvilket tillader opløsningen at lede elektricitet.
Sammenfattende resulterer blanding af natriumhydroxidopløsning og saltsyre i en neutraliseringsreaktion, der danner vand og natriumchlorid som produkter. Reaktionen frigiver varme og ændrer opløsningens pH til neutral. Den resulterende opløsning indeholder natrium- og chloridioner, som bidrager til dens øgede ledningsevne.
 Varme artikler
Varme artikler
-
 Isdannelse på overflader forstærket via en ikke-klassisk kernedannelsesprocesIskernedannelse på fremmede overflader kan forløbe via både et-trins (magenta pil) og to-trins (orange pile) veje, lettet af den afbalancerede synergetik, entropiske effekter af sekskantede (grønne ku
Isdannelse på overflader forstærket via en ikke-klassisk kernedannelsesprocesIskernedannelse på fremmede overflader kan forløbe via både et-trins (magenta pil) og to-trins (orange pile) veje, lettet af den afbalancerede synergetik, entropiske effekter af sekskantede (grønne ku -
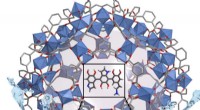 Fjernelse af tungmetaller fra vand med MOF'erEn organisk metalramme kan fjerne bly fra vandprøver, få dem til EPA-godkendte niveauer på få sekunder. Kredit:American Chemical Society Det anslås, at 1 milliard mennesker ikke har adgang til ren
Fjernelse af tungmetaller fra vand med MOF'erEn organisk metalramme kan fjerne bly fra vandprøver, få dem til EPA-godkendte niveauer på få sekunder. Kredit:American Chemical Society Det anslås, at 1 milliard mennesker ikke har adgang til ren -
 Fremtiden for biobrændstoffer i mørketLab-dyrkede alger. Kredit:Elizabeth Hann/UCR Alger kunne konkurrere med petroleum som fremtidens brændstof, hvis blot processen med at dyrke det var mere effektiv. Takket være et stipendium fra Li
Fremtiden for biobrændstoffer i mørketLab-dyrkede alger. Kredit:Elizabeth Hann/UCR Alger kunne konkurrere med petroleum som fremtidens brændstof, hvis blot processen med at dyrke det var mere effektiv. Takket være et stipendium fra Li -
 Ser man på en fremtid, hvor afisning af fly hører fortiden tilKredit:Alexey Lesik, Shutterstock Ved hjælp af nanoteknologi, forskere skaber nye flybelægninger, der afviser vand og forhindrer dannelse af is. Når is ophobes på flyoverflader, det forstyrrer fl
Ser man på en fremtid, hvor afisning af fly hører fortiden tilKredit:Alexey Lesik, Shutterstock Ved hjælp af nanoteknologi, forskere skaber nye flybelægninger, der afviser vand og forhindrer dannelse af is. Når is ophobes på flyoverflader, det forstyrrer fl
- Mellemøstlig ørkenstøv på det tibetanske plateau kan påvirke den indiske sommermonsun
- Forskere bringer polymerer i fokus på atomskala
- Hvordan bremser tyngdekraften en bil?
- Jernmangel begrænser marine mikrober
- Ny undersøgelse tyder på, at den oprindelige placering af Bayeux-tapetet endelig er løst
- Ny teknik kan registrere urenheder i hakket oksekød inden for få minutter


