65 ml hcl titreres med en opløsning 0,15 m koh det kræver 44 at nå ækvivalenspunktet hvilken koncentration opløsning?
HCl + KOH → KCl + H2O
Trin 2:Konverter volumenet af HCl fra milliliter til liter.
65 ml HCI =0,065 L HCI
Trin 3:Beregn antallet af mol HCl i 0,065 L opløsningen.
n(HCl) =c(HCl) × V(HCl)
n(HCl) =0,15 mol/L x 0,065 L
n(HCl) =0,00975 mol HCI
Trin 4:Brug molforholdet fra den afbalancerede kemiske ligning til at beregne antallet af mol KOH, der kræves for at nå ækvivalenspunktet.
Fra den afbalancerede kemiske ligning ved vi, at 1 mol HCl reagerer med 1 mol KOH. Derfor er antallet af krævede mol KOH også 0,00975 mol.
Trin 5:Beregn koncentrationen af KOH-opløsningen.
c(KOH) =n(KOH) / V(KOH)
c(KOH) =0,00975 mol/0,044 L
c(KOH) =0,2216 mol/L eller 0,222 M
Derfor er koncentrationen af KOH-opløsningen 0,222 M.
 Varme artikler
Varme artikler
-
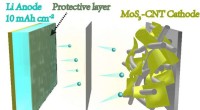 Kemikere finder en ny måde at skabe lithiummetalelektroder til batterierDette billede viser den skematiske struktur af en ny battericelle med lithiummetalelektroder udviklet ved Yale og Donghua University. Kredit:Yale University Forskere ved Yale og Donghua University
Kemikere finder en ny måde at skabe lithiummetalelektroder til batterierDette billede viser den skematiske struktur af en ny battericelle med lithiummetalelektroder udviklet ved Yale og Donghua University. Kredit:Yale University Forskere ved Yale og Donghua University -
 Var ursuppen en solid pre-protein gryderet?De første livspolymerer kan være opstået ved en daglig proces, der stadig observeres på Jorden i dag, såsom gentagen tørring og genopfyldning af damvand. Kredit:Ram Krishnamurthy / Center for Chemical
Var ursuppen en solid pre-protein gryderet?De første livspolymerer kan være opstået ved en daglig proces, der stadig observeres på Jorden i dag, såsom gentagen tørring og genopfyldning af damvand. Kredit:Ram Krishnamurthy / Center for Chemical -
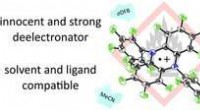 Kemikere producerer nye oxidanter som et værktøj til præparativ kemiKredit: Angewandte Chemie (2020). DOI:10.1002/ange.202002768 Kemisk oxidation, selektiv fjernelse af elektroner fra et substrat, repræsenterer en af de vigtigste transformationer i kemi. Imidle
Kemikere producerer nye oxidanter som et værktøj til præparativ kemiKredit: Angewandte Chemie (2020). DOI:10.1002/ange.202002768 Kemisk oxidation, selektiv fjernelse af elektroner fra et substrat, repræsenterer en af de vigtigste transformationer i kemi. Imidle -
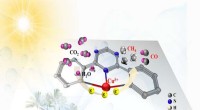 Ny katalysator øger radikalt omdannelseshastigheden af kuldioxid til solbrændstofferForskere konstruerede en enkelt atom katalysator (SAC) med en kovalent triazin-baseret ramme, hvormed fotokatalytisk CO2 blev omdannet til solenergi. Den fremstillede fotokatalysator udviste fremragen
Ny katalysator øger radikalt omdannelseshastigheden af kuldioxid til solbrændstofferForskere konstruerede en enkelt atom katalysator (SAC) med en kovalent triazin-baseret ramme, hvormed fotokatalytisk CO2 blev omdannet til solenergi. Den fremstillede fotokatalysator udviste fremragen
- Nyt indblik i, hvordan Giants Causeway og Devils Postpile blev dannet
- NOAA lancerer to kystmodeller til søfartssikkerhed på vestkysten, mexicanske Golf
- Lys-vridende chiral nanoteknologi kunne fremskynde lægemiddelscreening
- Bedre vandmodel under ekstreme forhold kunne hjælpe med at forstå jordens kappe
- Fysikere udvikler kvanteforstærkede sensorer til virkelige applikationer
- Gad vide om du har symptomer på coronavirus? Siri kan hjælpe


