Lys-vridende chiral nanoteknologi kunne fremskynde lægemiddelscreening
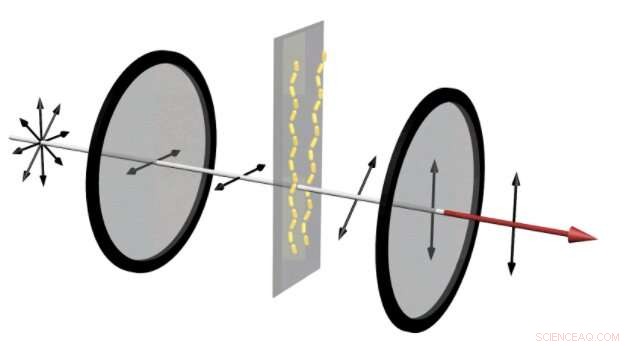
I en enhed, der kan afsløre, om amyloidproteiner samles i kæder, upolariseret lys kommer ind i en vandret polarisator. Dette tillader kun bølger, der svinger i vandret retning, at trænge igennem. Derefter, hvis amyloidproteinerne har samlet guld nanoroderne i kæder, rødt lys bliver snoet, ændring af vinklen på dens polarisering. Derefter, når den passerer gennem den lodrette polarisator, den del af lyset, der svinger i lodret retning, slipper igennem. Dette resulterer i et stærkt rødt signal, som kan ses med det blotte øje. Kredit:Jun Lu, Jilin University og University of Michigan
En ny tilgang fremstiller flydende krystallignende beacons ud af skadelige amyloidproteiner, der er til stede i sygdomme som type II diabetes.
I en ny lægemiddelscreeningsteknik, der er afhængig af guld nanorods til at vride lys, et rødt skær kan signalere svigt af en medicin, der er designet til at behandle "amyloide" sygdomme som type II diabetes og bugspytkirtelkræft.
Teknikken er udviklet af forskere fra University of Michigan, Jilin University i Kina, og det føderale universitet i São Carlos i Brasilien. Det udnytter en egenskab kaldet "kiralitet, "som findes i nanostrukturer, biologiske molekyler som proteiner, og lysbølger. Et chiralt objekt kan ikke overlejres på sit spejlbillede, som en venstre og højre hånd, eller spiraler, der snoer sig i forskellige retninger.
Forskerne var i stand til at drage fordel af chiraliteten af en proteinmarkør for disse sygdomme, kaldet islet amyloid polypeptider. Disse proteiner forbindes i snoede kæder og akkumuleres i væv. Amyloidproteiner, der danner proptrækkerformede fibre, spiller også en rolle ved Parkinsons og Huntingtons sygdom.
I den nye tilgang, guld nanorods er belagt med de skadelige proteiner, som danner lange fjederformede fibre med tre nanorods pr. Disse strukturer fremstår lyse røde, når de ses mellem to modsat vinklede polarisatorer, eller lysfiltre, fordi deres vridning, chirale former kan vende lysets polarisering.
"Den kraftige drejning af lyset gør det muligt at se resultaterne af lægemiddelscreeningen med det blotte øje, i stedet for at bruge komplicerede instrumenter, " sagde Kun Liu, en professor i kemi ved Jilin University og co-korresponderende forfatter på et papir nyligt offentliggjort i Videnskab .

I enheden til venstre, guld nanorods tillader en lille mængde lys gennem de to krydsede polarisatorer. Dette er beslægtet med signalet, der viser, at et lægemiddel, der er designet til at forhindre, at amyloide plaques dannes, virker. Imidlertid, når amyloidproteinerne samler guldnanoroderne til helixer, et klart rødt lys er synligt gennem polarisatorerne, afsløre, at et lægemiddel har fejlet. Kredit:Jun Lu, Jilin University og University of Michigan
Nanoroderne - hver omkring 50 nanometer lange og 20 nanometer brede - tilbyder yderligere fordele.
"De periodiske spiralformede kæder øger lysets vridning med 4, 600 gange, hvilket gør dem synlige under meget vanskelige biologiske forhold. Og nanoroderne fremskynder også processen med at danne amyloidkæder, som er afgørende for hurtig opdagelse af lægemidler, sagde Nicholas Kotov, co-korresponderende forfatter til papiret og Irving Langmuir Distinguished University Professor of Chemical Sciences and Engineering ved U-M.
Typisk, amyloidpolypeptider tager et par dage til en uge at forbinde. Dette forsinker testningen af potentielle lægemidler. Nanoroderne fremskynder processen med amyloidpolypeptider til en dag. Dette sker, fordi stængerne er belagt med et overfladeaktivt kemikalie kaldet cetrimoniumbromid, ligner det cetrimoniumchlorid, der findes i nogle shampoo og balsam. Når amyloidproteinerne binder sig til guldstangens tønde, det overfladeaktive middel hjælper dem med at danne en oprullet form, der letter binding til andre amyloider.
Når amyloiderne forbinder, deres guldstænger danner en helix, sno sig rundt om proteinrebet. Og fordi guldet interagerer stærkt med rødt lys, disse højt organiserede helixer vrider røde lysbølger meget kraftigt.
Det er det, der fører til den nemme opdagelse af, om et lægemiddel til at forhindre amyloidkæder har virket eller ej. Opsætningen sætter den realistiske blanding af celler, blodkomponenter, lægemiddelmolekyler og amyloidproteiner, som lægemidler møder i kroppen mellem to polarisatorer. Den første polarisator tillader kun lys at passere, hvis det svinger i lodret retning. Den anden polarisator passerer kun lysbølger, der bevæger sig i vandret retning.
Hvis lyset ikke vrider sig mellem de to polarisatorer, de to polarisatorer blokerer lyset fuldstændigt. Dette er, hvad der sker, når et lægemiddel er vellykket:Der dannes ingen amyloidkæder, så kun nogle få tilfældige nanorods vrider lyset. Der kommer meget lidt lys gennem de to polarisatorer. Imidlertid, hvis disse kæder dannes, de drejer rødt lys. Et rødt skær bliver tydeligt synligt - hvilket viser, at stoffet har fejlet.
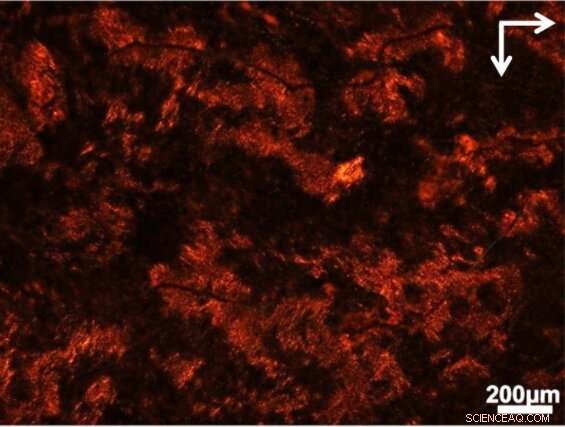
Udsigten gennem polarisatoren viser, hvor lysvridende strukturer er dannet i en suppe af celler og biologiske materialer. Kredit:Jun Lu, Jilin University og University of Michigan
"Mens eksperimenterne finjusterede betingelserne bedst for at detektere amyloidkæder, computersimuleringerne var grundlæggende for at optrevle de komplekse interaktioner mellem guld, overfladeaktive stoffer og proteinfragmenter, som skal interagere samtidigt for at få platformen til at fungere, sagde André de Moura, en professor ved Federal University of São Carlos og medforfatter til papiret.
Det internationale team etablerede også samlende designprincipper for, hvordan man laver snoede nanostrukturer, der kan vride lys markant, en funktion, der er kritisk for mange applikationer.
Værket repræsenterer en syv-årig rejse for Jun Lu, nu forskningsstipendiat i kemiteknik ved U-M. I begyndelsen af sin ph.d. under Liu i Kina, Lu startede med at prøve at lokke menneskelige ø-amyloidpolypeptider til at samle sig selv, med guldstænger påsat. Efter cirka et år, han og Liu havde fundet svage tegn på, at forsamlingerne snoede lyset. Efter et serendipitalt møde i lufthavnen med Kotov, holdet begyndte at arbejde på mekanismen for lysinteraktioner og de farmaceutiske anvendelser af disse samlinger.
Lu arbejdede på at gøre effekten større, dimensionering af nanorods for at komplementere afstanden mellem nanorods. Det internationale team udforskede applikationen til lægemiddelscreening, og Lu udviklede simuleringer ved hjælp af den kraftfulde Great Lakes supercomputer ved University of Michigan – mens hans samarbejdspartner ved University of São Paulo i Brasilien, Kalil Bernardino, brugte SDumont Supercomputer - til at bekræfte mekanismerne bag de eksperimentelle målinger.
Mens projektet var langt, Lu siger, "Hver indsats bliver godt belønnet. Det er ligesom en drøm, der går i opfyldelse."
Artiklen har titlen "Forbedring af optisk asymmetri i supramolekylære chiroplasmoniske samlinger med lang rækkefølge, " og vil blive offentliggjort online af tidsskriftet Videnskab på torsdag, 25. februar, 2021.
 Varme artikler
Varme artikler
-
 Fjerndetektion af vira på overfladerBlokdiagram over den foreslåede behandlingsplatform til klassificering (positiv eller negativ) af væskeprøver med lentivirale partikler og kvantificering af deres viral belastning. Væskeprøver aflejre
Fjerndetektion af vira på overfladerBlokdiagram over den foreslåede behandlingsplatform til klassificering (positiv eller negativ) af væskeprøver med lentivirale partikler og kvantificering af deres viral belastning. Væskeprøver aflejre -
 Atomfilm af smeltende guld kan hjælpe med at designe materialer til fremtidige fusionsreaktorerMega-elektron volt elektrondiffraktionsundersøgelser af den ultrahurtige fast-væske faseovergang i enkeltkrystallinsk guld. (A til C) Snapshots af de rå diffraktionsmønstre ved selektive pumpesondefor
Atomfilm af smeltende guld kan hjælpe med at designe materialer til fremtidige fusionsreaktorerMega-elektron volt elektrondiffraktionsundersøgelser af den ultrahurtige fast-væske faseovergang i enkeltkrystallinsk guld. (A til C) Snapshots af de rå diffraktionsmønstre ved selektive pumpesondefor -
 Brug af organoider til at forstå, hvordan hjernen rynkerFluorescensbilleder viser udviklingen af en organoid over dag 3-11, hvor fremkomsten af rynker tydeligt ses. Kredit:Weizmann Institute of Science Et team af forskere, der arbejder ved Weizmann
Brug af organoider til at forstå, hvordan hjernen rynkerFluorescensbilleder viser udviklingen af en organoid over dag 3-11, hvor fremkomsten af rynker tydeligt ses. Kredit:Weizmann Institute of Science Et team af forskere, der arbejder ved Weizmann -
 Hvordan hænger fisk og fugle sammen? Forskere finder, at svaret er en vågne med formålFisk og fugle kan bevæge sig i grupper, uden at skille eller kollidere, på grund af en nyopdaget dynamik:tilhængerne interagerer med kølvandet på lederne. Fundet giver ny indsigt i dyrs bevægelse og p
Hvordan hænger fisk og fugle sammen? Forskere finder, at svaret er en vågne med formålFisk og fugle kan bevæge sig i grupper, uden at skille eller kollidere, på grund af en nyopdaget dynamik:tilhængerne interagerer med kølvandet på lederne. Fundet giver ny indsigt i dyrs bevægelse og p
- Forsker ser fremtiden for hør og hamp som spånpladealternativ
- Smog vender tilbage til den indiske hovedstad, da landbrugsbrande starter
- Stærkere vinde opvarmer Vestantarktis issmeltning
- Breadmaking robot start øjne friske forbindelser
- Borgerforskere opdager ledsagerstjernen fra APMPM J2036-4936
- Sommerdøde zoner i Chesapeake Bay brød tidligere op


