En 7,81x10-3 mol prøve af oxygengas blev anbragt i en 0,355L beholder ved 398 K, hvad er trykket kPa, som gassen udøver?
$$PV =nRT$$
hvor:
* P er trykket af gassen i atmosfærer (atm)
* V er volumenet af gassen i liter (L)
* n er antallet af mol gas
* R er den ideelle gaskonstant (0,08206 L atm / mol K)
* T er gassens temperatur i Kelvin (K)
I dette tilfælde har vi:
* n =7,81 x 10-3 mol
* V =0,355 L
* T =398 K
Ved at erstatte disse værdier i den ideelle gasligning får vi:
$$P =\frac{nRT}{V}$$
$$P =\frac{(7,81x10-3 mol)(0,08206 L atm/mol K)(398 K)}{0,355 L}$$
$$P =7,16 atm$$
Konvertering af atm til kPa:
P =7,16 atm * 101,325 kPa/atm =728 kPa
Derfor er trykket, som iltgassen udøver, 728 kPa.
Sidste artikelHvordan øger man gastrykket?
Næste artikelNår en prøve af gas afkøles i lukket beholder, trykket inde i beholderen?
 Varme artikler
Varme artikler
-
 Meget selektiv genvinding af lanthanider via lagdelt vanadat med syre- og strålingsbestandighedSelektiv genvinding af lanthanider med et krystallinsk simpelt vanadat med syre- og strålingsbestandighed. Kredit:Prof. FENG Med udviklingen af atomenergi, miljøhensyn forbundet med det nukleare
Meget selektiv genvinding af lanthanider via lagdelt vanadat med syre- og strålingsbestandighedSelektiv genvinding af lanthanider med et krystallinsk simpelt vanadat med syre- og strålingsbestandighed. Kredit:Prof. FENG Med udviklingen af atomenergi, miljøhensyn forbundet med det nukleare -
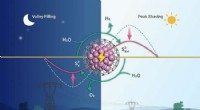 Meget effektive ringbrynjekatalysatorer udviklet til afkoblet vandelektrolyseEffektiv afkoblet vandelektrolyseanordning realiserede peak barbering og dalfyldning af elektricitet. Kredit:ZHANG Mo Afkoblet elektrolyse af vand er en lovende strategi for spidsbelastningsregule
Meget effektive ringbrynjekatalysatorer udviklet til afkoblet vandelektrolyseEffektiv afkoblet vandelektrolyseanordning realiserede peak barbering og dalfyldning af elektricitet. Kredit:ZHANG Mo Afkoblet elektrolyse af vand er en lovende strategi for spidsbelastningsregule -
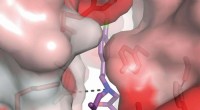 Målrettet skjult lomme til behandling af slagtilfælde og anfaldEn kemisk forbindelse i 93-serien slutter sig til en neurons NMDA-receptor. Forbindelser som denne har en høj affinitet for receptoren på grund af et unikt motiv, der trækkes ind i en skjult lomme (il
Målrettet skjult lomme til behandling af slagtilfælde og anfaldEn kemisk forbindelse i 93-serien slutter sig til en neurons NMDA-receptor. Forbindelser som denne har en høj affinitet for receptoren på grund af et unikt motiv, der trækkes ind i en skjult lomme (il -
 Undersøgelse viser, at keramik kan deformere som metaller, hvis det sintres under et elektrisk feltPurdue-forskere observerede for første gang, hvordan keramik dannet under et elektrisk felt overraskende ændrer form i stedet for at gå i stykker, når det komprimeres ved høj belastning. På billedet:U
Undersøgelse viser, at keramik kan deformere som metaller, hvis det sintres under et elektrisk feltPurdue-forskere observerede for første gang, hvordan keramik dannet under et elektrisk felt overraskende ændrer form i stedet for at gå i stykker, når det komprimeres ved høj belastning. På billedet:U
- Ozon på lavere breddegrader genoprettes ikke, på trods af helbredelse af det antarktiske ozonhul
- Bombay beach -begivenhed viser vanskeligheder ved prognoser for jordskælvsværm
- Hvordan glatte overflader tillader klæbrige pastaer og geler at glide
- Ioniserede molekyler sporer galaktiske udstrømninger
- Crowdsourcet stamtræ giver ny indsigt om menneskeheden
- Mikrobielle strukturer i den antarktiske sø kunne afsløre mere om, hvordan livet udviklede sig


