Hvordan øger man gastrykket?
Reduktion af volumen:Komprimering af en gas reducerer den plads, der er til rådighed for molekyler til at bevæge sig, hvilket får dem til at kollidere hyppigere og med større kraft. Det reducerede volumen fører til en stigning i gastrykket.
Tilføjelse af flere gasmolekyler:Indføring af flere gasmolekyler i et fast volumen øger antallet af partikler, der kolliderer med beholdervæggene. Det større antal kollisioner øger det samlede tryk, som gassen udøver.
Reduktion af temperaturen, mens volumen holdes konstant:Selvom dette scenarie kan virke kontraintuitivt, kan en sænkning af temperaturen ved konstant volumen indirekte øge gastrykket. Afkøling af gassen nedsætter molekylernes molekylære bevægelse og kinetiske energi til en vis grad. På grund af det konstante beholdervolumen kan molekylerne dog ikke sprede sig helt ud og sprede deres reducerede energi. I stedet tillader det lille fald i molekylær energi flere molekyler at optage det givne volumen, hvilket effektivt øger tætheden. Denne fortætning bidrager til en lille stigning i gastrykket.
Ændring af sammensætningen af gasblandingen:Udskiftning af en komponentgas med en anden gas, der har andre egenskaber, såsom molekylvægt eller intermolekylære kræfter, kan påvirke den samlede trykadfærd. Indføring af en tættere gas eller en gas med stærkere intermolekylære kræfter kan øge trykket sammenlignet med den oprindelige gassammensætning.
 Varme artikler
Varme artikler
-
 Forskere præsenterer ny strategi for at udvide duktiliteten i en enfaset legeringA. Multilevel heterogen struktur af enfaset CrCoNi medium entropi-legering efter træktest:korn på størrelse med mikrometer (hvide), submikronkorn (blå), nanokorn (farvede). Nanograin dannes ved korngr
Forskere præsenterer ny strategi for at udvide duktiliteten i en enfaset legeringA. Multilevel heterogen struktur af enfaset CrCoNi medium entropi-legering efter træktest:korn på størrelse med mikrometer (hvide), submikronkorn (blå), nanokorn (farvede). Nanograin dannes ved korngr -
 Nær-infrarøde reflekterende blandingsbelægninger har bedre optisk og køleydelseKredit:DOI:10.1016/j.solener.2021.06.061 Kinesiske forskere fandt for nylig, at en nær-infrarød reflekterende blandingscoating havde bedre optisk og køleydelse, derved reducerer den absorberede en
Nær-infrarøde reflekterende blandingsbelægninger har bedre optisk og køleydelseKredit:DOI:10.1016/j.solener.2021.06.061 Kinesiske forskere fandt for nylig, at en nær-infrarød reflekterende blandingscoating havde bedre optisk og køleydelse, derved reducerer den absorberede en -
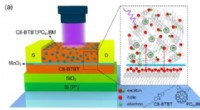 Forskere udvikler ultrafølsomme organiske fototransistorer baseret på en ny hybridlagsarkitekturStrukturen af hybrid-lag fototransistor. Kredit:LI Jia Organiske fototransistorer (OPTer) er meget udbredt i miljø-/sundhedsovervågning, kvantekommunikation, kemisk/biomedicinsk sansning, fjernb
Forskere udvikler ultrafølsomme organiske fototransistorer baseret på en ny hybridlagsarkitekturStrukturen af hybrid-lag fototransistor. Kredit:LI Jia Organiske fototransistorer (OPTer) er meget udbredt i miljø-/sundhedsovervågning, kvantekommunikation, kemisk/biomedicinsk sansning, fjernb -
 Lysemitterende elektrokemiske celler til genanvendelig belysningKredit:Technical University München En lavpris og let at fremstille lysteknologi kan fremstilles med lys-emitterende elektrokemiske celler. Sådanne celler er tyndfilm elektroniske og ioniske enhede
Lysemitterende elektrokemiske celler til genanvendelig belysningKredit:Technical University München En lavpris og let at fremstille lysteknologi kan fremstilles med lys-emitterende elektrokemiske celler. Sådanne celler er tyndfilm elektroniske og ioniske enhede
- Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydning
- Hvad er BPA, og hvorfor er det i så mange plastikprodukter?
- Forskere fanger kolliderende organiske nanopartikler på video for første gang
- Regeringen, lærere og rektorer på vej i forskellige retninger om, hvorfor Asien-kompetence er vigt…
- Tre ting, det videnskabelige samfund kan gøre for at filtrere skitseret forskning
- Uhyggelig bevarelse:Redning af truede arter over vores døde kroppe


