Opfører ionforbindelser og molekyler ens, når de opløses?
1. Dissociation vs. Solvation :
- Ioniske forbindelser:Når en ionisk forbindelse opløses i et opløsningsmiddel, adskiller dens bestanddele ioner fra hinanden. Ionerne bliver solvatiseret af opløsningsmiddelmolekylerne, hvilket betyder, at opløsningsmiddelmolekyler omgiver og interagerer med dem.
- Molekylære stoffer:Molekylære stoffer dissocierer generelt ikke til ioner, når de opløses. I stedet opløser opløsningsmiddelmolekylerne hele molekylet og danner en homogen blanding.
2. Konduktivitet :
- Ionforbindelser:Opløsninger af ionforbindelser er gode ledere af elektricitet, fordi de opløste ioner kan bevæge sig frit under påvirkning af et elektrisk felt.
- Molekylære stoffer:Opløsninger af molekylære stoffer er typisk dårlige ledere af elektricitet, fordi der ikke er frie ioner til stede.
3. Kogepunkt og frysepunkt :
- Ioniske forbindelser:Opløsninger, der indeholder ioniske forbindelser, har generelt højere kogepunkter og lavere frysepunkter sammenlignet med rene opløsningsmidler. Denne effekt kaldes henholdsvis kogepunktsforhøjelse og frysepunktssænkning.
- Molekylære stoffer:Opløsninger, der indeholder molekylære stoffer, kan vise små ændringer i koge- og frysepunkter, men virkningerne er generelt mindre sammenlignet med ioniske forbindelser.
4. Koligative egenskaber :
- Ioniske forbindelser:Ioniske forbindelser bidrager med flere ioner til opløsningen, hvilket fører til mere udtalte kolligative egenskaber såsom osmotisk tryk og damptrykssænkning.
- Molekylære stoffer:Molekylære stoffer bidrager, afhængigt af deres størrelse og koncentration, med en relativt mindre effekt på kolligative egenskaber sammenlignet med ioniske forbindelser.
5. Kemiske reaktioner :
- Ioniske forbindelser:Opløsning af ioniske forbindelser i visse opløsningsmidler kan føre til kemiske reaktioner, såsom hydrolyse i tilfælde af vand som opløsningsmiddel.
- Molekylære stoffer:Molekylære stoffer gennemgår normalt ikke kemiske reaktioner ved opløsning i et opløsningsmiddel, medmindre opløsningsmidlet er kemisk reaktivt.
Disse forskelle opstår fra den grundlæggende natur af ioniske forbindelser (sammensat af ioner holdt sammen af elektrostatiske kræfter) og molekylære stoffer (kovalente forbindelser holdt sammen af kovalente bindinger). Tilstedeværelsen af frie ioner i opløsning giver anledning til de unikke egenskaber, der observeres i ioniske forbindelser.
Det er vigtigt at bemærke, at der kan være undtagelser og variationer afhængigt af de specifikke forbindelser, opløsningsmiddel og betingelser.
 Varme artikler
Varme artikler
-
 Nøglen er i belægningen:Flerlagsbelægning for at forbedre korrosionsbestandigheden af stålFlerlagsbelægningen har vist høj modstandsdygtighed over for rust og kan have vidtrækkende konsekvenser på byggeområdet. Kredit:Korea Maritime &Ocean University Stålets styrke gør det til et af de
Nøglen er i belægningen:Flerlagsbelægning for at forbedre korrosionsbestandigheden af stålFlerlagsbelægningen har vist høj modstandsdygtighed over for rust og kan have vidtrækkende konsekvenser på byggeområdet. Kredit:Korea Maritime &Ocean University Stålets styrke gør det til et af de -
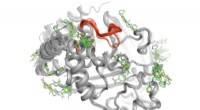 Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak
Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak -
 Den hemmelige styrke ved gnidning af tænderForskere på området har i forsøg fundet ud af, at tilføjelse af små defekter til glas kan øge materialets styrke 200 gange. Kredit:Jilbert Ebrahimi via Unsplash Tændernes styrke er angivet på skal
Den hemmelige styrke ved gnidning af tænderForskere på området har i forsøg fundet ud af, at tilføjelse af små defekter til glas kan øge materialets styrke 200 gange. Kredit:Jilbert Ebrahimi via Unsplash Tændernes styrke er angivet på skal -
 Livet af et skumTre eksperimenter om bord på Maxus 6-sonderaketten vil undersøge skumets egenskaber. Maxus 6-sonende raket er planlagt til opsendelse fra Esrange, Swedish Space Corporation raketbase nær Kiruna, i det
Livet af et skumTre eksperimenter om bord på Maxus 6-sonderaketten vil undersøge skumets egenskaber. Maxus 6-sonende raket er planlagt til opsendelse fra Esrange, Swedish Space Corporation raketbase nær Kiruna, i det
- Rhode Island School of Design arbejder sammen med NASA om Mars-dragt
- Selvdrevet e-ur drives fuldstændig af håndledsbevægelser
- Lytte til laviner i nanoskala af atomer i krystaller
- Forskere afslører, hvordan molekylære vejspærringer bremser nedbrydningen af cellulose til biob…
- Glaselektroder brugt i nanoskala pumpe
- Forskere afslører den katalytiske mekanisme af lovastatinhydrolase


