Hvor mange natriumioner er der i vandigt fosfat, hvis prøvestørrelsen er 500 milliliter og koncentration 2 Molaritet?
C(Na+) =C(phosphat) x (n(Na+)/n(phosphat))
hvor:
C(Na+) er koncentrationen af natriumioner i mol/L
C(phosphat) er koncentrationen af fosfat i mol/L
n(Na+) er antallet af natriumioner i fosfatmolekylet
n(phosphat) er antallet af fosfationer i fosfatmolekylet
I dette tilfælde er koncentrationen af fosfat angivet som 2 Molaritet. Da fosfat-ionen har 3 natriumioner, er n(Na+)/n(phosphat) 3. Derfor:
C(Na+) =2 Molaritet x 3 =6 Molaritet
For at beregne antallet af natriumioner, der er til stede i 500 milliliter af denne opløsning, kan vi bruge formlen:
N(Na+) =C(Na+) x V
hvor:
N(Na+) er antallet af natriumioner
C(Na+) er koncentrationen af natriumioner i mol/L
V er opløsningens rumfang i liter
Erstatning af de givne værdier:
N(Na+) =6 Molaritet x 0,5 L =3 mol
Derfor er der 3 mol natriumioner til stede i 500 milliliter 2 molaritets vandig fosfat.
 Varme artikler
Varme artikler
-
 Lægemiddelinducerede cellulære membrankomplekser inducerer cancercelledødOgretmen, vist her i hans laboratorium på Hollings Cancer Center, siger, at disse indledende fund er et positivt skridt i søgen efter mere effektive kræftlægemidler. Kredit:Emma Vought Gamle molek
Lægemiddelinducerede cellulære membrankomplekser inducerer cancercelledødOgretmen, vist her i hans laboratorium på Hollings Cancer Center, siger, at disse indledende fund er et positivt skridt i søgen efter mere effektive kræftlægemidler. Kredit:Emma Vought Gamle molek -
 Syntetisk kanal med en stærk præference for kaliumioner tilbyder hurtig transport gennem kunstig m…Dette scanningselektronmikroskopbillede viser, at de kunstige ionkanaler selv samler sig til fibre. Kredit:American Chemical Society Kunstige ionkanaler udviklet af A*STAR-forskere kan bane vejen
Syntetisk kanal med en stærk præference for kaliumioner tilbyder hurtig transport gennem kunstig m…Dette scanningselektronmikroskopbillede viser, at de kunstige ionkanaler selv samler sig til fibre. Kredit:American Chemical Society Kunstige ionkanaler udviklet af A*STAR-forskere kan bane vejen -
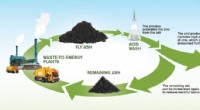 Udvinding af ædle zink fra affaldsaskeEn illustration af processen til genvinding af zink. Kredit:Yen Strandqvist/Chalmers Tekniske Universitet Forbrænding af fast affald producerer årligt millioner af tons affald flyveaske i Europa;
Udvinding af ædle zink fra affaldsaskeEn illustration af processen til genvinding af zink. Kredit:Yen Strandqvist/Chalmers Tekniske Universitet Forbrænding af fast affald producerer årligt millioner af tons affald flyveaske i Europa; -
 Vanilje får mælkedrikke til at virke sødereKredit:CC0 Public Domain Tilsætning af vanilje til sødet mælk får forbrugerne til at tro, at drikkevaren er sødere, gør det muligt at reducere mængden af tilsat sukker, ifølge forskere fra Penn
Vanilje får mælkedrikke til at virke sødereKredit:CC0 Public Domain Tilsætning af vanilje til sødet mælk får forbrugerne til at tro, at drikkevaren er sødere, gør det muligt at reducere mængden af tilsat sukker, ifølge forskere fra Penn
- Hvilke grundstoffer grupperede Mendeleev med lithium?
- Sådan fungerer fjernelse af offentlige monumenter
- Sådan fungerer haglgeværer
- Hepatitis D:Hvordan virussen fik til at springe fra dyr til mennesker
- Hunde er døde efter at have slikket en almindelig kemoterapicreme, advarer FDA
- Hvorfor blev den anden atombombe kastet?


