Hvorfor er kogepunktet for H2O meget højere end h2se?
H2O har et meget højere kogepunkt end H2Se på grund af forskellen i deres intermolekylære kræfter. H2O-molekyler holdes sammen af hydrogenbinding, som er en stærk intermolekylær kraft. Hydrogenbinding opstår, når et brintatom i et molekyle er bundet til et meget elektronegativt atom, såsom oxygen eller nitrogen. Det elektronegative atom trækker brintatomets elektronsky mod sig selv og skaber en delvis positiv ladning på brintatomet. Denne delvise positive ladning tiltrækker derefter den delvise negative ladning på et andet elektronegativt atom og danner en hydrogenbinding.
H2Se-molekyler på den anden side holdes sammen af van der Waals-kræfter, som er meget svagere intermolekylære kræfter. Van der Waals-kræfter opstår, når elektronskyerne i to molekyler kortvarigt overlapper hinanden, hvilket skaber en midlertidig dipol. Disse dipoler tiltrækker så hinanden og danner en van der Waals-kraft.
Fordi hydrogenbinding er en meget stærkere intermolekylær kraft end van der Waals-kræfter, holdes H2O-molekyler sammen meget tættere end H2Se-molekyler. Det betyder, at det kræver mere energi at bryde de intermolekylære kræfter mellem H2O-molekyler og få dem til at koge. Derfor er kogepunktet for H2O meget højere end kogepunktet for H2Se.
Ud over hydrogenbinding kan forskellen i kogepunkterne for H2O og H2Se også tilskrives forskellen i deres molekylære masser. H2O har en molekylvægt på 18 g/mol, mens H2Se har en molekylvægt på 80 g/mol. Jo tungere molekylet er, jo mere energi tager det at bryde de intermolekylære kræfter mellem dets molekyler og få det til at koge. Derfor har det tungere H2Se-molekyle et højere kogepunkt end det lettere H2O-molekyle.
 Varme artikler
Varme artikler
-
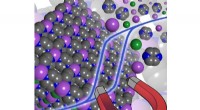 Mod næste generation af molekyle-baserede magneterBilledgengivelse af den molekylebaserede magnet og dens magnetiske egenskaber. Kredit:Rodolphe Clérac Magneter anvendes i en række teknologiske applikationer, inklusive satellitter, telefoner og k
Mod næste generation af molekyle-baserede magneterBilledgengivelse af den molekylebaserede magnet og dens magnetiske egenskaber. Kredit:Rodolphe Clérac Magneter anvendes i en række teknologiske applikationer, inklusive satellitter, telefoner og k -
 Ny indsigt i større sygdomsforløbKredit:CC0 Public Domain Flinders forskere har gjort store indgreb i at finde årsagen til hjertesygdomme, Alzheimers, Kræft, diabetes og andre sygdomme efter at have opdaget yderligere 148 protein
Ny indsigt i større sygdomsforløbKredit:CC0 Public Domain Flinders forskere har gjort store indgreb i at finde årsagen til hjertesygdomme, Alzheimers, Kræft, diabetes og andre sygdomme efter at have opdaget yderligere 148 protein -
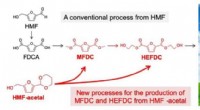 Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli
Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli -
 Undersøgelse af vaping-partikelstørrelse og aflejringKredit:American Chemical Society Brugen af e-cigaretter er stigende, især blandt unge voksne og teenagere. Nylige sygdomme og dødsfald, der tilskrives vaping, har forårsaget intens undersøgelse
Undersøgelse af vaping-partikelstørrelse og aflejringKredit:American Chemical Society Brugen af e-cigaretter er stigende, især blandt unge voksne og teenagere. Nylige sygdomme og dødsfald, der tilskrives vaping, har forårsaget intens undersøgelse
- Østrigs privatlivsaktivister anlægger sag mod streamingwebsteder
- Nøjagtig kortlægning af menneskelige rejsemønstre med globale smartphonedata
- Instagram-chefen insisterer på, at den ikke udspionerer brugerne
- Atlantic haven er et testbed for planeters sygelige oceaner
- Holde jordbær friske ved hjælp af bioaktiv emballage
- Hvad er definitionen på tilsat sukker?


