En gasprøve holdes ved konstant temperatur. Hvad sker der med trykket, hvis volumen fordobles og antal molekyler fordobles?
I dette tilfælde, hvis volumenet fordobles og antallet af molekyler fordobles, mens temperaturen forbliver konstant, vil virkningerne på trykket fra begge faktorer ophæve hinanden. En fordobling af volumen ville reducere trykket til det halve, mens en fordobling af antallet af molekyler ville øge trykket med en faktor på to. Derfor vil den overordnede effekt på trykket være:
$$P_2 =P_1 \times \frac{V_1}{2V_2} \times \frac{2N_2}{N_1}$$
$$P_2 =P_1 \ gange 1 \ gange 1 $ $
$$P_2 =P_1$$
Derfor vil gassens tryk forblive det samme som starttrykket.
 Varme artikler
Varme artikler
-
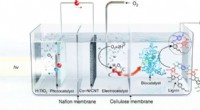 Nyt biokatalytisk system gør affaldsbiomasse til værdiskabende kemikalierSkematisk illustration af den tre-rums foto-elektro-biokemiske reaktor. Kredit:UNIST Et forskerhold, i fællesskab ledet af professor Ji Wook Jang, Professor Yong Hwan Kim, og professor Sang Hoon J
Nyt biokatalytisk system gør affaldsbiomasse til værdiskabende kemikalierSkematisk illustration af den tre-rums foto-elektro-biokemiske reaktor. Kredit:UNIST Et forskerhold, i fællesskab ledet af professor Ji Wook Jang, Professor Yong Hwan Kim, og professor Sang Hoon J -
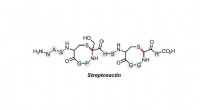 Lab opdager et lille Cain-and-Abel-molekyleStrukturen af det nyopdagede lille molekyle Streptosactin. Kredit:Leah Bushin. Et nyt bakteriemolekyle med den usmagelige tendens til at opspore og dræbe andre af sin egen art er blevet opdaget
Lab opdager et lille Cain-and-Abel-molekyleStrukturen af det nyopdagede lille molekyle Streptosactin. Kredit:Leah Bushin. Et nyt bakteriemolekyle med den usmagelige tendens til at opspore og dræbe andre af sin egen art er blevet opdaget -
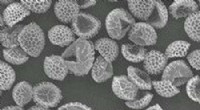 Rengøring af forurenende stoffer fra vand med pollen og sporer - uden achoo!De fyldte overflader af behandlede sporkorn, her vist forstørret cirka 300 gange, kan fjerne uønskede kemikalier fra forurenet vand. Kredit:Andrew Boa og Aimilia Meichanetzoglou Ud over deres roll
Rengøring af forurenende stoffer fra vand med pollen og sporer - uden achoo!De fyldte overflader af behandlede sporkorn, her vist forstørret cirka 300 gange, kan fjerne uønskede kemikalier fra forurenet vand. Kredit:Andrew Boa og Aimilia Meichanetzoglou Ud over deres roll -
 Verdens første bioklodser dyrket fra menneskelig urinVerdens første bio-klods lavet af menneskelig urin blev afsløret på UCT i denne uge. På billedet er (fra venstre) Department of Civil Engineering Dr. Dyllon Randall og hans studerende, Vukheta Mukhari
Verdens første bioklodser dyrket fra menneskelig urinVerdens første bio-klods lavet af menneskelig urin blev afsløret på UCT i denne uge. På billedet er (fra venstre) Department of Civil Engineering Dr. Dyllon Randall og hans studerende, Vukheta Mukhari
- Uhyggelige kvantepartikelpar flyver som underlige kurvekugler
- Hvorfor skal kemiske ligninger balanceres?
- Hvordan en rejse til Antarktis blev et eksperiment i det virkelige liv i beslutningstagning
- Grundvandsundersøgelser kan blive forurenet af overlevelsesforstyrrelser
- Tundrabiomens pingviner
- Højere luftforureningsdage udløser hjertestop og hospitalsindlæggelser


