Hvor mange gram Ca-OH-2 er nødvendige for at fremstille 100 ml opløsning 0,1 M Ca-OH-2?
Den molære masse af Ca(OH)2 er 74,09 g/mol.
Trin 2:Beregn antallet af mol Ca(OH)2, der er nødvendigt for at fremstille 100 mL af en 0,1 M opløsning.
Antallet af nødvendige mol Ca(OH)2 kan beregnes ved hjælp af formlen:
```
Mol Ca(OH)2 =Koncentration (i mol/L) × Volumen af opløsning (i L)
```
I dette tilfælde er koncentrationen 0,1 M og volumenet af opløsningen er 100 ml, hvilket svarer til 0,1 L.
```
Mol Ca(OH)2 =0,1 mol/L × 0,1 L =0,01 mol
```
Trin 3:Beregn den nødvendige masse af Ca(OH)2.
Den nødvendige masse af Ca(OH)2 kan beregnes ved at gange antallet af mol med den molære masse.
```
Masse af Ca(OH)2 =Mol af Ca(OH)2 × Molær masse af Ca(OH)2
```
I dette tilfælde er antallet af mol 0,01 mol, og den molære masse af Ca(OH)2 er 74,09 g/mol.
```
Masse af Ca(OH)2 =0,01 mol × 74,09 g/mol =0,7409 g
```
Derfor er 0,7409 gram Ca(OH)2 nødvendige for at fremstille 100 ml af en 0,1 M Ca(OH)2-opløsning.
Sidste artikelHvad repræsenterer atomsymbolet i en Lewis-struktur?
Næste artikelEr natriumhydrogencarbonat ionisk eller kovalent?
 Varme artikler
Varme artikler
-
 Fremstilling af læderlignende materialer fra svampeKredit:Pixabay/CC0 Public Domain Traditionelt læder og dets alternativer fås typisk fra dyr og syntetiske polymerer. Læder kan betragtes som et samprodukt af kødproduktion med både husdyrbrug og l
Fremstilling af læderlignende materialer fra svampeKredit:Pixabay/CC0 Public Domain Traditionelt læder og dets alternativer fås typisk fra dyr og syntetiske polymerer. Læder kan betragtes som et samprodukt af kødproduktion med både husdyrbrug og l -
 En molekylær trojansk hestDe wienske videnskabsmænd ledet af Maulide udviklede en metode, der anvender en 4-leddet ringprecursor til hurtigt at samle makrocyklussen af de naturlige produkter. Kredit:Giovanni Di Mauro/Maulide
En molekylær trojansk hestDe wienske videnskabsmænd ledet af Maulide udviklede en metode, der anvender en 4-leddet ringprecursor til hurtigt at samle makrocyklussen af de naturlige produkter. Kredit:Giovanni Di Mauro/Maulide -
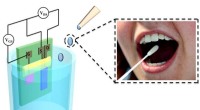 Biologisk sensor kan registrere glukoseniveauer i spyt mere præcist og omkostningseffektivt end blo…Forskere har udviklet en meget følsom, nøjagtig, fleksibel og overkommelig biologisk sensor, der kan registrere glukoseniveauer i spyt. Kredit:Hong Kong Polytechnic University Diabetes er en stofs
Biologisk sensor kan registrere glukoseniveauer i spyt mere præcist og omkostningseffektivt end blo…Forskere har udviklet en meget følsom, nøjagtig, fleksibel og overkommelig biologisk sensor, der kan registrere glukoseniveauer i spyt. Kredit:Hong Kong Polytechnic University Diabetes er en stofs -
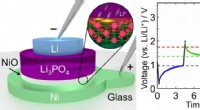 Lille, hurtig, og meget energieffektiv hukommelsesenhed inspireret af lithium-ion-batterierDe stablede lag i den foreslåede hukommelsesenhed danner et minibatteri, der hurtigt og effektivt kan skiftes mellem tre forskellige spændingstilstande (0,95 V, 1,35 V, og 1,80 V). Kredit:ACS Applied
Lille, hurtig, og meget energieffektiv hukommelsesenhed inspireret af lithium-ion-batterierDe stablede lag i den foreslåede hukommelsesenhed danner et minibatteri, der hurtigt og effektivt kan skiftes mellem tre forskellige spændingstilstande (0,95 V, 1,35 V, og 1,80 V). Kredit:ACS Applied
- Holografisk linseudskrivningsmetode kunne tillade udskrivning af teleskoplinser i rummet
- Ny forskning bringer os tættere på DIY spray-on solcelleteknologi
- Sommerfugle kaster lys over, hvordan nogle arter reagerer på global opvarmning
- Det tosprogede molekyle forbinder to grundlæggende koder for livet
- Californiens nye normale kan være mere intens varme, brande, tørke og oversvømmelser
- En kraftig koldfront:Hvorfor Australien ser på en uge med hårdt koldt vejr


