Hvorfor kan der dannes brintbindinger mellem vandmolekyler?
Her er en dybere forklaring på hydrogenbinding i vand:
1. Polaritet af vandmolekyler:
• Vandmolekyler er polære molekyler, hvilket betyder, at de har en delvis positiv ladning på brintatomerne og en delvis negativ ladning på iltatomet.
• Denne polaritet opstår, fordi oxygen har en højere elektronegativitet end hydrogen, og trækker de delte elektroner i O-H-bindingen tættere på sig selv. Som følge heraf har oxygenatomet en højere elektrontæthed og bliver svagt negativt, mens brintatomet bliver svagt positivt.
2. Hydrogenbindingsdannelse:
• Det svagt positive brintatom i et vandmolekyle tiltrækkes af et andet vandmolekyles svagt negative oxygenatom.
• Denne tiltrækning fører til dannelsen af en brintbinding, en stærk intermolekylær kraft, der holder de to vandmolekyler sammen.
3. Flere hydrogenbindinger:
• Hvert vandmolekyle kan danne brintbindinger med op til fire andre vandmolekyler på grund af dets tetraedriske form og orienteringen af dets brint- og oxygenatomer.
• Denne evne til at danne flere brintbindinger er ansvarlig for vands unikke egenskaber, såsom dets høje overfladespænding, specifikke varmekapacitet og kogepunkt.
4. Styrken af hydrogenbindinger:
• Hydrogenbindinger er ikke så stærke som kovalente bindinger, men er stærkere end andre intermolekylære kræfter såsom van der Waals-kræfter.
• Styrken af hydrogenbindingen i vand er påvirket af elektronegativitetsforskellen mellem oxygen og brint og graden af ladningsadskillelse i molekylet.
Sammenfattende dannes der hydrogenbindinger mellem vandmolekyler på grund af vandmolekylets polære natur, hvilket gør det muligt for det let positive brintatom at blive tiltrukket af det lidt negative oxygenatom. Disse brintbindinger er ansvarlige for mange af vands unikke egenskaber og spiller en afgørende rolle i dets adfærd og interaktioner med andre stoffer.
Sidste artikelHvad er oxidationstallet for N?
Næste artikelHvad bruges metaller til og hvorfor?
 Varme artikler
Varme artikler
-
 Video:Nobelprisen i kemi 2017:Cryo-elektronmikroskopi forklaretKredit:The American Chemical Society Jacques Dubochet, Joachim Frank og Richard Henderson har krævet årets Nobelpris i kemi. Trioen tjente prisen for deres arbejde med kryo-elektronmikroskopi, so
Video:Nobelprisen i kemi 2017:Cryo-elektronmikroskopi forklaretKredit:The American Chemical Society Jacques Dubochet, Joachim Frank og Richard Henderson har krævet årets Nobelpris i kemi. Trioen tjente prisen for deres arbejde med kryo-elektronmikroskopi, so -
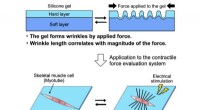 Forskere udvikler direkte mål for styrken af skeletmuskelmyotuberNår en kraft påføres et silikonegelsubstrat, opstår der rynker på overfladen. Det samme gælder, når et myotube på overfladen stimuleres med et elektrisk signal. Længden af rynkerne kan bruges til at
Forskere udvikler direkte mål for styrken af skeletmuskelmyotuberNår en kraft påføres et silikonegelsubstrat, opstår der rynker på overfladen. Det samme gælder, når et myotube på overfladen stimuleres med et elektrisk signal. Længden af rynkerne kan bruges til at -
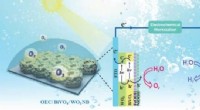 Forbedring af ydeevne til effektiv fotoelektrokemisk vandopdelingSom en af de mest lovende fotoanodekandidater til fotoelektronkemisk vandspaltning, er fotostrømtætheden og IPCE af BiVO4 blevet forbedret til 5 gange højere ved at konstruere OEC/BiVO4 og meget mat
Forbedring af ydeevne til effektiv fotoelektrokemisk vandopdelingSom en af de mest lovende fotoanodekandidater til fotoelektronkemisk vandspaltning, er fotostrømtætheden og IPCE af BiVO4 blevet forbedret til 5 gange højere ved at konstruere OEC/BiVO4 og meget mat -
 Belægning til metaller heler hurtigt over ridser og skrammer for at forhindre korrosionKredit:CC0 Public Domain Det er svært at tro, at en lille revne kan nedbryde en gigantisk metalkonstruktion. Men nogle gange falder broer sammen, rørledninger går i stykker og skrog løsner sig fra
Belægning til metaller heler hurtigt over ridser og skrammer for at forhindre korrosionKredit:CC0 Public Domain Det er svært at tro, at en lille revne kan nedbryde en gigantisk metalkonstruktion. Men nogle gange falder broer sammen, rørledninger går i stykker og skrog løsner sig fra
- Nye billeder viser et sort hul, der blæser kraftige vinde ud
- Flere amerikanske studerende studerer i udlandet, viser nye data
- Afled egenskaberne ved en ny form for diamant
- Ultrafølsom molekylær sansning med syntetisere komplekse frekvensbølger
- Unge i Tyskland er mere bekymrede over krig og klimaændringer end COVID
- Hvad er funktionen af kreatinfosfat?


