Hvorfor er adskillelse af vand i ilt og brint kemisk forandring?
Under elektrolyse udsættes vandmolekyler for en elektrisk strøm, som får H2O-molekylerne til at splitte fra hinanden. Denne opsplitning sker, fordi elektricitet giver den energi (aktiveringsenergi), der er nødvendig for at bryde de kemiske bindinger, der holder vandmolekylerne sammen. Ved katoden (negativ elektrode) får hydrogenioner (H+) elektroner fra den elektriske strøm og reduceres til brintgas (H2).
2H+ (vandig) + 2e- → H2 (gas)
Samtidig dannes der ved anoden (positiv elektrode) iltgas (O2), når oxygenioner (O2-) reagerer med vandmolekyler og frigiver elektroner tilbage i det elektriske kredsløb.
4OH- (vandig) → 2H2O(l) + O2 (g) + 4e-
Samlet set kan ligningen for vandelektrolyse repræsenteres som:
2H2O (l) → 2H2 (g) + O2 (g)
Da der under processen dannes nye stoffer, nemlig brint og oxygengas, gennem en kemisk reaktion drevet af en elektrisk strøm, betragtes elektrolyse af vand som en kemisk forandring.
Sidste artikelHvad er forskellen mellem vandkredsløb og iltkredsløb?
Næste artikelHvorfor er minedrift dårligt?
 Varme artikler
Varme artikler
-
 Nobelugen fortsætter med KemiprisenI denne mandag, 10. december, 2018 filbillede, en buste af Nobelprisstifteren, Alfred Nobel udstillet i Koncertsalen under Nobelprisuddelingen i Stockholm. Kontrovers forfølger Nobelpriserne for fred
Nobelugen fortsætter med KemiprisenI denne mandag, 10. december, 2018 filbillede, en buste af Nobelprisstifteren, Alfred Nobel udstillet i Koncertsalen under Nobelprisuddelingen i Stockholm. Kontrovers forfølger Nobelpriserne for fred -
 Diagnosticering af kunst acne i Georgia OKeeffes malerierKig tæt på et detaljeret afsnit af Pedernal viser fremspring i mikronstørrelse fra metalsæber.Georgia OKeeffe. Pedernal, 1941. Olie på lærred, 19 x 30 1/4 tommer. Georgia OKeeffe Museum. Gave fra Geor
Diagnosticering af kunst acne i Georgia OKeeffes malerierKig tæt på et detaljeret afsnit af Pedernal viser fremspring i mikronstørrelse fra metalsæber.Georgia OKeeffe. Pedernal, 1941. Olie på lærred, 19 x 30 1/4 tommer. Georgia OKeeffe Museum. Gave fra Geor -
 Svagt bundet salt er en nøgleingrediens til højrenhed Li@C60 filmForskere fra University of Tsukuba dyrkede med succes en Li@C60-film på en kobberoverflade for at studere de molekylære orbitaler. Kredit:University of Tsukuba Udover at gøre det til et af de mest
Svagt bundet salt er en nøgleingrediens til højrenhed Li@C60 filmForskere fra University of Tsukuba dyrkede med succes en Li@C60-film på en kobberoverflade for at studere de molekylære orbitaler. Kredit:University of Tsukuba Udover at gøre det til et af de mest -
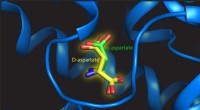 Montering af en højre hånd i en venstrehåndsvanteDenne illustration viser L- og D-aspartat på bindingsstedet for transportproteinet. Kredit:Valentina Arkhipova, University of Groningen Mange biomolekyler findes i to versioner, der er hinandens s
Montering af en højre hånd i en venstrehåndsvanteDenne illustration viser L- og D-aspartat på bindingsstedet for transportproteinet. Kredit:Valentina Arkhipova, University of Groningen Mange biomolekyler findes i to versioner, der er hinandens s
- Forskning kunne afsløre, hvordan menneskets sociale liv udviklede sig
- Sådan fuldføres Square
- Plantevidenskabelig forskning baner vejen for en dybere forståelse af, hvordan planters immunsystem…
- Ceres midlertidig atmosfære forbundet med solaktivitet
- En stabil kobberkatalysator til omdannelse af kuldioxid
- Billede:Proba-1 pyramidespotting


