Hvor mange miles af calciumnitrat ville reagere med 4,55 mol krom(III)sulfat for at producere kromnitrat?
Den afbalancerede kemiske ligning for reaktionen mellem calciumnitrat og chrom (III) sulfat er:
3Ca(NO3)2 + Cr2(SO4)3 → 3CaSO4 + 2Cr(NO3)3
Ud fra støkiometrien af den balancerede ligning kan vi se, at 3 mol calciumnitrat reagerer med 1 mol chrom (III) sulfat. Derfor ville 4,55 mol chrom (III) sulfat kræve:
(4,55 mol Cr2(SO4)3) × (3 mol Ca(NO3)2 / 1 mol Cr2(SO4)3) =13,65 mol Ca(NO3)2
Nu skal vi konvertere mol calciumnitrat til miles. Den molære masse af calciumnitrat er cirka 236 g/mol. Så 13,65 mol calciumnitrat svarer til:
(13,65 mol Ca(NO3)2) × (236 g/mol) =3224 g Ca(NO3)2
Hvis vi antager en massefylde på 2,5 g/cm³ for calciumnitrat, kan vi beregne rumfanget af 3224 g calciumnitrat:
Volumen =masse/densitet =(3224 g) / (2,5 g/cm³) =1289 cm³
Endelig kan vi konvertere volumen til miles ved at gange med den passende konverteringsfaktor:
1 mile =160934,4 cm
Derfor er 1289 cm³ =(1289 cm³) × (1 mile / 160934,4 cm³) ≈ 0,008 miles
Så cirka 0,008 miles af calciumnitrat ville være påkrævet for at reagere med 4,55 mol chrom (III) sulfat.
 Varme artikler
Varme artikler
-
 Polyamider fra terpener:Amorf Caramid-R og semi-krystallinsk Caramid-SFra træaffald til højtydende polymerer:Terpener fra terpentinolie omdannes til biobaserede, varmestabile polyamider. Kredit:Fraunhofer IGB Fraunhofer Institute for Interfacial Engineering and Biot
Polyamider fra terpener:Amorf Caramid-R og semi-krystallinsk Caramid-SFra træaffald til højtydende polymerer:Terpener fra terpentinolie omdannes til biobaserede, varmestabile polyamider. Kredit:Fraunhofer IGB Fraunhofer Institute for Interfacial Engineering and Biot -
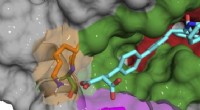 Ny strategi til præcist at målrette undertyper af nøgleproteinRøntgen-co-krystalstruktur af B52-forbindelse (cyan), der binder og hæmmer cyclophilin D-protein. Kredit:Aziz Rangwala Cyclosporin er et af de mest almindelige og effektive immunsuppressive lægemid
Ny strategi til præcist at målrette undertyper af nøgleproteinRøntgen-co-krystalstruktur af B52-forbindelse (cyan), der binder og hæmmer cyclophilin D-protein. Kredit:Aziz Rangwala Cyclosporin er et af de mest almindelige og effektive immunsuppressive lægemid -
 Forskere skaber bedre materiale til bærbare biosensorerMenneskelig hudstruktur. Kredit:Wikipedia Biosensorer, der kan bæres på menneskelig hud eller sikkert bruges inde i kroppen, er i stigende grad udbredt til både medicinske anvendelser og daglig su
Forskere skaber bedre materiale til bærbare biosensorerMenneskelig hudstruktur. Kredit:Wikipedia Biosensorer, der kan bæres på menneskelig hud eller sikkert bruges inde i kroppen, er i stigende grad udbredt til både medicinske anvendelser og daglig su -
 Forskere afslører robust ethan-fangende porøst organisk bur til effektiv anvendelse af ethylenrens…Kredit:Prof. YUANs gruppe Fjernelse af ethan (C 2 H 6 ) fra dets analoge ethylen (C 2 H 4 ) er af stor betydning i den petrokemiske industri, og er meget udfordrende på grund af deres lign
Forskere afslører robust ethan-fangende porøst organisk bur til effektiv anvendelse af ethylenrens…Kredit:Prof. YUANs gruppe Fjernelse af ethan (C 2 H 6 ) fra dets analoge ethylen (C 2 H 4 ) er af stor betydning i den petrokemiske industri, og er meget udfordrende på grund af deres lign
- Superledning:Hvilken af disse er ikke som den anden?
- Iagttagelse af materie-bølgediffraktion fra et periodisk array af halve planer
- Forskere udvikler guldkompleksbundne ferrocenylphosphiner som potente malariamidler
- Træt af adgangskoder? Udskift dem med dit fingeraftryk
- Fossile brændstoffer kan stadig bidrage til luftforurening, selv når bilen er slukket
- Gødning forårsager mere end 2 % af de globale emissioner


