Hvorfor er alkalimetallers smelte- og kogepunkt lavere sammenlignet med jordalkalimetaller?
1. Større atomstørrelse: Alkalimetaller har større atomstørrelser sammenlignet med jordalkalimetaller. Dette skyldes, at når vi bevæger os ned ad en gruppe i det periodiske system, stiger atomstørrelsen generelt. Denne stigning i atomstørrelse fører til svagere metallisk binding i alkalimetaller. Jo større atomstørrelsen er, jo svagere er de metalliske bindinger, og jo lavere er smelte- og kogepunkterne.
2. Svagere metallisk binding: Alkalimetaller har en enkelt valenselektron i deres yderste skal, mens jordalkalimetaller har to valenselektroner. Tilstedeværelsen af en yderligere valenselektron i jordalkalimetaller resulterer i stærkere metallisk binding. Stærkere metalliske bindinger kræver mere energi at bryde, hvilket fører til højere smelte- og kogepunkter.
3. Lavere ioniseringsenergi: Alkalimetaller har lavere ioniseringsenergi sammenlignet med jordalkalimetaller. Ioniseringsenergi refererer til den energi, der kræves for at fjerne en elektron fra et atom. Jo lavere ioniseringsenergi, jo lettere kan en elektron fjernes. Det betyder, at alkalimetaller lettere mister deres valenselektroner, hvilket resulterer i svagere metalliske bindinger og lavere smelte- og kogepunkter.
4. Mindre gitterenergi: Gitterenergi er den energi, der kræves for at adskille ioner i et krystalgitter. Alkalimetaller har mindre gitterenergier sammenlignet med jordalkalimetaller. Dette skyldes, at jo større ionerne er, jo svagere er den elektrostatiske tiltrækning mellem dem. Den mindre gitterenergi i alkalimetaller gør det lettere for ionerne at overvinde tiltrækningskræfterne og undslippe gitteret, hvilket resulterer i lavere smelte- og kogepunkter.
Sammenfattende fører kombinationen af større atomstørrelse, svagere metallisk binding, lavere ioniseringsenergi og mindre gitterenergi i alkalimetaller til lavere smelte- og kogepunkter sammenlignet med jordalkalimetaller.
Sidste artikelVille beryllium have egenskaber, der ligner magnesium?
Næste artikelHvordan er beryllium sililært for lithium?
 Varme artikler
Varme artikler
-
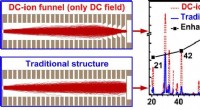 Forbedring af iontransmissionseffektiviteten af massespektrometreFokuseringseffekt af DC-ion-tragten. Kredit:Zhang Qiangling En nylig undersøgelse foretaget af forskere fra Hefei Institutes of Physical Science og offentliggjort i Analytical Chemistry præsenterer
Forbedring af iontransmissionseffektiviteten af massespektrometreFokuseringseffekt af DC-ion-tragten. Kredit:Zhang Qiangling En nylig undersøgelse foretaget af forskere fra Hefei Institutes of Physical Science og offentliggjort i Analytical Chemistry præsenterer -
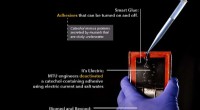 Ingeniører zapper og løsner smart undervandslimTænd og sluk for vedhæftning er det, der gør en lim smart. Det er én ting at gøre dette i det fri og noget helt andet under vand. Inspireret af naturen, katekoler er syntetiske forbindelser, der efter
Ingeniører zapper og løsner smart undervandslimTænd og sluk for vedhæftning er det, der gør en lim smart. Det er én ting at gøre dette i det fri og noget helt andet under vand. Inspireret af naturen, katekoler er syntetiske forbindelser, der efter -
 Leviterende proteiner kan hjælpe med at diagnosticere opioidmisbrug, andre sygdommeProteiner skabte specifikke former, når de blev leviteret, som et smiley ansigt af lag. Kredit:Michigan State University Forskere ved Michigan State Universitys Precision Health Program har hjulpe
Leviterende proteiner kan hjælpe med at diagnosticere opioidmisbrug, andre sygdommeProteiner skabte specifikke former, når de blev leviteret, som et smiley ansigt af lag. Kredit:Michigan State University Forskere ved Michigan State Universitys Precision Health Program har hjulpe -
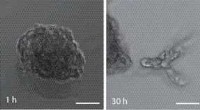 Dyrkning af mikrovæv til erstatning for dyreforsøgVed at bruge princippet om litografi, en infrarød laser skriver præcise strukturer ind i matricen. Cellerne vokser efter den specificerede plan. Dette åbner nye muligheder for generering af tredimensi
Dyrkning af mikrovæv til erstatning for dyreforsøgVed at bruge princippet om litografi, en infrarød laser skriver præcise strukturer ind i matricen. Cellerne vokser efter den specificerede plan. Dette åbner nye muligheder for generering af tredimensi
- Bundsediment afslører, at klimaændringer flyder ud i søer
- 3C 17 er medlem af en nyligt identificeret galaksehob, observationer afslører
- Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidler
- Er vi alene? Sætter nogle grænser for vores unikke karakter
- Ny NASA-visualisering undersøger den lysbøjende dans af binære sorte huller
- Rapport viser, at offentlige myndigheder skal tage klimaforandringer alvorligt


