Hvorfor skaber zink og kobber en højere spænding end i kredsløbet?
Når zink og kobber er forbundet i et kredsløb, opstår følgende reaktioner:
1. Oxidation ved zinkelektroden (anode):
Zn(s) → Zn^(2+) (aq) + 2e-
Zinkatomer mister to elektroner og opløses i elektrolytten som positivt ladede zinkioner (Zn^(2+)). Disse elektroner bliver tilgængelige i kredsløbet.
2. Reduktion ved kobberelektroden (katode):
Cu^(2+) (aq) + 2e- → Cu(s)
Kobberioner i elektrolytten får to elektroner fra kredsløbet og aflejres som kobberatomer på kobberelektroden.
Denne redoxreaktion skaber en potentialforskel mellem zink- og kobberelektroderne. Zinkelektroden bliver negativt ladet på grund af de overskydende elektroner, mens kobberelektroden bliver positivt ladet på grund af at kobberionerne tiltrækker elektronerne. Denne potentialforskel driver strømmen af elektroner i kredsløbet og genererer en elektrisk strøm.
Styrken af den producerede spænding afhænger af forskellen i reduktionspotentialer mellem anode- og katodematerialerne. I dette tilfælde er standardreduktionspotentialet for Zn^(2+) / Zn -0,76 V, mens det for Cu^(2+) / Cu er +0,34 V. Den samlede cellespænding er cirka forskellen mellem disse potentialer, hvilket er omkring 1,1 V.
Brug af andre metaller med mere ekstreme standardreduktionspotentialer kan give højere spændingsoutput fra voltaiske celler.
Sidste artikelHvad er perlens fysiske egenskaber?
Næste artikelEr denne kulstofkæde mættet eller umættet C C?
 Varme artikler
Varme artikler
-
 Nyt membranmateriale kunne gøre rensning af gasser væsentligt mere effektivKredit:Unsplash/CC0 Public Domain Industrielle processer til kemisk adskillelse, herunder naturgasrensning og produktion af oxygen og nitrogen til medicinsk eller industriel brug, er tilsammen ansv
Nyt membranmateriale kunne gøre rensning af gasser væsentligt mere effektivKredit:Unsplash/CC0 Public Domain Industrielle processer til kemisk adskillelse, herunder naturgasrensning og produktion af oxygen og nitrogen til medicinsk eller industriel brug, er tilsammen ansv -
 Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge
Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge -
 Lovende nye katalysatorer til brintbrændselscellerKredit:Alyssa Stone/Northeastern University Brintbrændselsceller lover meget som bæredygtige og miljøvenlige energikilder til at drive transport til lands, i luften og til vands. Men traditionelle
Lovende nye katalysatorer til brintbrændselscellerKredit:Alyssa Stone/Northeastern University Brintbrændselsceller lover meget som bæredygtige og miljøvenlige energikilder til at drive transport til lands, i luften og til vands. Men traditionelle -
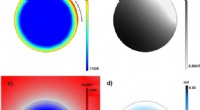 Udvikling af 3-D partikelmodel for enkeltpartikler i batterielektroderElektrokemiske fænomener inde i en enkelt partikel forudsagt ved hjælp af den udviklede model. a) Opladet tilstand; b) Elektrisk potentiale; c) Lithiumkoncentration; d) Spænding. Kredit:DGIST Der
Udvikling af 3-D partikelmodel for enkeltpartikler i batterielektroderElektrokemiske fænomener inde i en enkelt partikel forudsagt ved hjælp af den udviklede model. a) Opladet tilstand; b) Elektrisk potentiale; c) Lithiumkoncentration; d) Spænding. Kredit:DGIST Der
- Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisen
- Hvad tager producenter af Star Wars-film galt med androider
- Varmebølger kan stige betydeligt i størrelse i midten af århundredet, siger ny undersøgelse
- Hvordan man holder forsyningskæderne i gang under en katastrofe
- Kvasarjetfly forvirrer orbitalteleskopet
- Udsætte Californiens olieboringsbeskyttelse indtil 2031? Ingen måde


