Hvad menes der med et opløst stofs opløselighed?
Den maksimale mængde af et opløst stof, der kan opløses i en given mængde opløsningsmiddel ved en bestemt temperatur og tryk, er kendt som dets opløselighed. Det repræsenterer det omfang, i hvilket et opløst stof opløses i et opløsningsmiddel for at danne en homogen blanding eller opløsning. Et stofs opløselighed afhænger af flere faktorer såsom temperatur, tryk, arten af det opløste stof og opløsningsmidlet og tilstedeværelsen af andre opløste stoffer eller urenheder.
Nøglepunkter:
Maksimal mængde:Opløselighed refererer til den maksimale mængde af et opløst stof, der kan opløses i en specifik mængde opløsningsmiddel under definerede betingelser.
Temperaturafhængighed:Opløseligheden af de fleste faste stoffer i væsker stiger med stigende temperatur. Når temperaturen stiger, stiger den kinetiske energi af opløsningsmiddelmolekylerne, hvilket øger deres evne til at bryde opløste partikler fra hinanden og lette opløsning.
Trykafhængighed:For gasser opløst i væsker stiger opløseligheden med stigende tryk. Højere tryk tvinger flere gasmolekyler ind i væsken, hvilket resulterer i en højere koncentration af den opløste gas.
Interaktioner mellem opløst stof og opløsningsmiddel:Naturen af det opløste stof og opløsningsmidlet spiller en afgørende rolle ved bestemmelse af opløselighed. Jo stærkere de intermolekylære kræfter mellem opløst stof og opløsningsmiddelpartikler, jo højere er opløseligheden. Polære opløste stoffer har tendens til at være mere opløselige i polære opløsningsmidler, mens upolære opløste stoffer er mere opløselige i ikke-polære opløsningsmidler.
Mætningspunkt:Når en opløsning indeholder den maksimalt mulige mængde af opløst stof, siges den at være mættet. På dette tidspunkt er ligevægten mellem opløsning og udfældning etableret.
Virkning af urenheder:Tilstedeværelsen af urenheder eller yderligere opløste stoffer kan påvirke opløseligheden af et stof. Nogle urenheder kan konkurrere med det opløste stof om opløsningsmiddelmolekyler, hvilket reducerer dets opløselighed, mens andre kan øge opløseligheden ved at ændre opløsningsmidlets egenskaber.
Opløselighedsenheder:Opløselighed udtrykkes ofte i kvantitative termer, såsom gram opløst stof per 100 gram opløsningsmiddel (g/100 g) eller mol opløst stof per liter opløsningsmiddel (mol/L).
Eksempler:
- Bordsalt (NaCl) har en høj opløselighed i vand på grund af den stærke tiltrækning mellem natrium- og chloridioner og vandmolekyler.
- Sukker (saccharose) opløses også let i vand på grund af dannelsen af hydrogenbindinger mellem dets hydroxylgrupper og vandmolekyler.
- Iltgas har relativt lav opløselighed i vand ved stuetemperatur og -tryk sammenlignet med kuldioxid, som er mere opløseligt på grund af sin polære natur.
Sammenfattende er opløselighed en grundlæggende egenskab, der bestemmer, i hvilket omfang et stof kan opløses i et opløsningsmiddel. Det afhænger af forskellige faktorer, herunder temperatur, tryk, arten af det opløste stof og opløsningsmidlet og tilstedeværelsen af andre stoffer. Forståelse af opløselighed er afgørende inden for adskillige videnskabelige områder, herunder kemi, farmaci og miljøvidenskab.
Sidste artikelHvad opløser de fleste opløste stoffer?
Næste artikelHvad sker der, hvis du blander calciumhypochlorit og kuldioxid?
 Varme artikler
Varme artikler
-
 Forskning ved hjælp af atomsondetomografi afslører sprækker i jernkrystaller, der kan helesVed hjælp af jernisotoper og atomsondetomografi, eller APT, forskere skaber de første 3D atomkort over omarrangementet af forskellige jernatomer i en lille jernoxidkrystal. Kredit:PNNL Som jern, d
Forskning ved hjælp af atomsondetomografi afslører sprækker i jernkrystaller, der kan helesVed hjælp af jernisotoper og atomsondetomografi, eller APT, forskere skaber de første 3D atomkort over omarrangementet af forskellige jernatomer i en lille jernoxidkrystal. Kredit:PNNL Som jern, d -
 Forskere gør modeaffald til multifunktionelt materialeEt forskerhold ledet af lektor Hai Minh Duong (til venstre) og professor Nhan Phan-Thien fra Institut for Maskinteknik ved National University of Singapores Engineering Faculty har udtænkt en hurtig,
Forskere gør modeaffald til multifunktionelt materialeEt forskerhold ledet af lektor Hai Minh Duong (til venstre) og professor Nhan Phan-Thien fra Institut for Maskinteknik ved National University of Singapores Engineering Faculty har udtænkt en hurtig, -
 Farmakoskopi muliggør opdagelse af immunmodulerende lægemidler ved at analysere immuncelleinterakt…Gregory Vladimer, Nikolaus Krall, Berend Snijder og Giulio Superti-Furga (fra venstre mod højre) er ved siden af Pharmacoscopy high-throughput mikroskop. Kredit:Wolfgang Däuble/CeMM Immunsysteme
Farmakoskopi muliggør opdagelse af immunmodulerende lægemidler ved at analysere immuncelleinterakt…Gregory Vladimer, Nikolaus Krall, Berend Snijder og Giulio Superti-Furga (fra venstre mod højre) er ved siden af Pharmacoscopy high-throughput mikroskop. Kredit:Wolfgang Däuble/CeMM Immunsysteme -
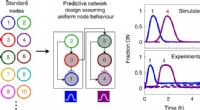 Et skridt mod skabelsen af materialer styret af kunstige generKredit:Samuel W. Schaffter et al., Nature Chemistry (2022). DOI:10.1038/s41557-022-01001-3 Vores kroppes gener arbejder sammen om at regulere, hvordan vores celler opfører sig. Hvis du f.eks. flår
Et skridt mod skabelsen af materialer styret af kunstige generKredit:Samuel W. Schaffter et al., Nature Chemistry (2022). DOI:10.1038/s41557-022-01001-3 Vores kroppes gener arbejder sammen om at regulere, hvordan vores celler opfører sig. Hvis du f.eks. flår
- Tuberkuler af søpindsvin fundet at have et Voronoi-mønster
- Astronomer opdager en kæmpe planet, der kredser om en brun dværg
- Klæbrigt vand holder nøglen til antifouling overflader
- Team forudsiger brugstiden for batterier med data og AI
- Asteroide 1998 OR2 flyver sikkert forbi Jorden i denne uge
- Reduceret energi fra solen kan forekomme i midten af århundredet - nu ved forskerne hvor meget


