Hvorfor dannes ioniske forbindelser mellem metaller og ikke-metaller?
Når et metal og et ikke-metal kommer i kontakt, mister metalatomet en eller flere af sine valenselektroner til ikke-metalatomet. Denne overførsel af elektroner skaber positivt ladede metalioner og negativt ladede ikke-metalioner. Den elektrostatiske tiltrækning mellem disse modsat ladede ioner holder den ioniske forbindelse sammen.
For eksempel, når natrium (et metal) og chlor (et ikke-metal) reagerer, mister natriumatomet sin enkeltvalenselektron til chloratomet. Dette resulterer i dannelsen af natriumioner (Na+) og chloridioner (Cl-). Den elektrostatiske tiltrækning mellem natriumioner og chloridioner fører til dannelsen af den ioniske forbindelse natriumchlorid (NaCl).
Ioniske forbindelser er karakteriseret ved deres høje smelte- og kogepunkter, opløselighed i polære opløsningsmidler (såsom vand) og evne til at lede elektricitet, når de opløses i vand eller smeltes.
Sidste artikelHvad er Mg2CrO4?
Næste artikelHvad er forholdet mellem neutron og proton i en stabil form for kulstof 12?
 Varme artikler
Varme artikler
-
 Direkte syntese af hydrogenperoxid ved hjælp af TS-1 understøttede katalysatorerHAADF-billeder af 2,4% Au - 2,4% Pd - 0,2% Pt / TS-1 calcineret prøve. Kredit:Dr Qian He Hydrogenperoxid (H 2 O 2 ) har mange industrielle anvendelser, fra vandbehandling og blegning til kemis
Direkte syntese af hydrogenperoxid ved hjælp af TS-1 understøttede katalysatorerHAADF-billeder af 2,4% Au - 2,4% Pd - 0,2% Pt / TS-1 calcineret prøve. Kredit:Dr Qian He Hydrogenperoxid (H 2 O 2 ) har mange industrielle anvendelser, fra vandbehandling og blegning til kemis -
 Får mac og ost til MarsWSU kandidatstuderende Juhi Patel, en forfatter på mac og ost papir, sætter pakker med lilla kartofler i en inkubator, hvilket fremskynder ændringerne i fødevarekvaliteten med en ensartet hastighed. K
Får mac og ost til MarsWSU kandidatstuderende Juhi Patel, en forfatter på mac og ost papir, sætter pakker med lilla kartofler i en inkubator, hvilket fremskynder ændringerne i fødevarekvaliteten med en ensartet hastighed. K -
 Terminatorlignende flydende metal bevæger sig og strækker sig i 3D-rumKredit:American Chemical Society I blockbusteren Terminator film franchise, en ond robot forvandler sig til forskellige menneskelige former og objekter og oser gennem smalle åbninger, takket vær
Terminatorlignende flydende metal bevæger sig og strækker sig i 3D-rumKredit:American Chemical Society I blockbusteren Terminator film franchise, en ond robot forvandler sig til forskellige menneskelige former og objekter og oser gennem smalle åbninger, takket vær -
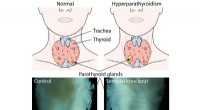 Opdagelse af signalprotein kan føre til lægemiddelbaserede terapier til behandling af hyperparathy…Fire små biskjoldbruskkirtler placeret i nakken bag den større skjoldbruskkirtel er ansvarlige for at styre sunde blodcalciumniveauer. Primær hyperparatyreoidisme er præget af overdreven parathyreoide
Opdagelse af signalprotein kan føre til lægemiddelbaserede terapier til behandling af hyperparathy…Fire små biskjoldbruskkirtler placeret i nakken bag den større skjoldbruskkirtel er ansvarlige for at styre sunde blodcalciumniveauer. Primær hyperparatyreoidisme er præget af overdreven parathyreoide
- Nedslagskraterdataanalyse af Ryugu-asteroiden belyser kompliceret geologisk historie
- ARS bomuldsforskud hjælper med at starte sårforbinding
- Vende visningen:Nyt mikroskop tilbyder muligheder for opdagelse af lægemidler, sikkerhed
- Indonesierne rydder op på stranden én sandal ad gangen
- Amerikanske astronauter drømmer om at se rummet blive til virkelighed
- Hvad er løsningerne til druer, der påvirkes af klimaændringer?


