Hvorfor er natrium og fluor meget reaktive, mens neon næsten ikke viser nogen reaktivitet?
Derimod har neon en høj ioniseringsenergi og en lav elektronegativitet, hvilket betyder, at det er svært at fjerne en elektron fra et neonatom og svært for et neonatom at acceptere en elektron. Dette gør neon meget ureaktivt, og det danner ikke stabile forbindelser med andre grundstoffer.
Her er en tabel, der opsummerer de vigtigste forskelle mellem natrium, fluor og neon:
| Element | Ioniseringsenergi (eV) | Elektronegativitet | Reaktivitet |
|---|---|---|---|
| Natrium | 5,14 | 0,93 | Meget reaktiv |
| Fluor | 17.42 | 3,98 | Meget reaktiv |
| Neon | 21.56 | 0,0 | Næsten ingen reaktivitet |
Sidste artikelHvad hvis følgende er et eksempel på en bronsted-lowry syre?
Næste artikelHvilken forbindelse består af aluminium og ilt?
 Varme artikler
Varme artikler
-
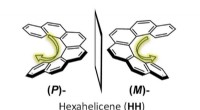 Håber på udvikling af materialer til 3-D skærme og medicinske applikationerEnantiomerer af hexahelicen. Kredit:Osaka University Chirale molekyler er spejlbilleder af hinanden. De kan ikke overlejres og spiller en afgørende rolle i avancerede materialer og teknologier. Im
Håber på udvikling af materialer til 3-D skærme og medicinske applikationerEnantiomerer af hexahelicen. Kredit:Osaka University Chirale molekyler er spejlbilleder af hinanden. De kan ikke overlejres og spiller en afgørende rolle i avancerede materialer og teknologier. Im -
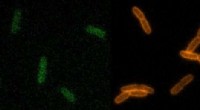 Forskning går fremad med søgning efter nye antibiotikaCellevæggene i levende bakterier lyser grønt, orange og rød med tre forskellige typer RfDAA -prober. Kredit:VanNieuwenhze Lab, Indiana University Indiana University forskere fremmer viden om, hvor
Forskning går fremad med søgning efter nye antibiotikaCellevæggene i levende bakterier lyser grønt, orange og rød med tre forskellige typer RfDAA -prober. Kredit:VanNieuwenhze Lab, Indiana University Indiana University forskere fremmer viden om, hvor -
 Smarte dielektriske elastomerer til selvhelende bløde robotterTid og spænding for en skærebladaktuator og helet bladaktuator Kredit:WMG, University of Warwick Robotter, der ligner organer, er kendt som bløde robotter, og for at de kan fungere, skal de være l
Smarte dielektriske elastomerer til selvhelende bløde robotterTid og spænding for en skærebladaktuator og helet bladaktuator Kredit:WMG, University of Warwick Robotter, der ligner organer, er kendt som bløde robotter, og for at de kan fungere, skal de være l -
 Blod fra stofbrugere kan afsløre stoffets oprindelseMirjam de Bruin-Hoegée udfører en kemisk analyse med LC-Orbitrap-MS. Kredit:University of Amsterdam Opioiden fentanyl bruges ikke kun i medicinsk praksis som smertestillende, men er også et populæ
Blod fra stofbrugere kan afsløre stoffets oprindelseMirjam de Bruin-Hoegée udfører en kemisk analyse med LC-Orbitrap-MS. Kredit:University of Amsterdam Opioiden fentanyl bruges ikke kun i medicinsk praksis som smertestillende, men er også et populæ
- Arizona-kløften berømt for, at vandfald åbner igen efter oversvømmelser
- Anvendelsen af NPN Transistorer
- Fjernarbejde midt i coronavirus-pandemien:3 løsninger
- Indiens kulværksplaner er i konflikt med klimaforpligtelser
- Hubble-astronomer samler vid udsigt over det udviklende univers
- Hvad størrelsesfordelingen af organismer fortæller os om en søs energiske effektivitet


