Hvad er reaktionsvarme og entalpireaktion?
Reaktionsvarmen refererer til mængden af varme absorberet eller frigivet under en kemisk reaktion. Det er forskellen i entalpi mellem produkterne og reaktanterne af en reaktion. En positiv værdi for $\Delta H$ indikerer en endoterm reaktion, hvilket betyder, at varme absorberes fra omgivelserne for at bryde bindinger i reaktanterne og danne nye bindinger i produkterne. Omvendt indikerer en negativ værdi for $\Delta H$ en eksoterm reaktion, hvilket betyder, at der frigives varme til omgivelserne, når bindinger dannes og brydes under reaktionen.
Entalpireaktion $(\Delta H_{rxn})$:
Entalpireaktion er en specifik type reaktionsvarme, der refererer til ændringen i entalpien, der opstår under en kemisk reaktion ved konstant tryk. Det er defineret som forskellen mellem produkternes samlede entalpi og reaktanternes samlede entalpi:
$$\Delta H_{rxn} =\Sigma H_{produkter} - \Sigma H_{reaktanter}$$
Et stofs entalpi refererer til dets samlede energiindhold, inklusive indre energi og den energi, der er forbundet med dets position og bevægelse. I forbindelse med kemiske reaktioner repræsenterer ændringen i entalpi den nettoenergi, der absorberes eller frigives under omdannelsen af reaktanter til produkter.
Sammenfattende er reaktionsvarmen et generelt udtryk, der refererer til mængden af varme, der er involveret i en kemisk reaktion, mens entalpireaktion specifikt refererer til ændringen i entalpien, der opstår ved konstant tryk under en kemisk reaktion.
Sidste artikelHvordan omdannes gas fra væske til form i gasflaske?
Næste artikelAtomnummeret er et atoms?
 Varme artikler
Varme artikler
-
 Cyborg-teknologi kunne muliggøre ny diagnostik, fusion af mennesker og AIMolekylær model af PEDOT med maleimid; kulstofatomer er grå, oxygen røde, nitrogen blå, svovler gule og hydrogener hvide. Kredit:David Martin Selvom sande cyborgs - delvist er menneskelige, delvis
Cyborg-teknologi kunne muliggøre ny diagnostik, fusion af mennesker og AIMolekylær model af PEDOT med maleimid; kulstofatomer er grå, oxygen røde, nitrogen blå, svovler gule og hydrogener hvide. Kredit:David Martin Selvom sande cyborgs - delvist er menneskelige, delvis -
 Forskere opdager en effektiv og bæredygtig måde at filtrere salt- og metalioner fra vand påKredit:CC0 Public Domain Med to milliarder mennesker verden over mangler adgang til rent og sikkert drikkevand, fælles forskning fra Monash University, CSIRO og University of Texas i Austin offent
Forskere opdager en effektiv og bæredygtig måde at filtrere salt- og metalioner fra vand påKredit:CC0 Public Domain Med to milliarder mennesker verden over mangler adgang til rent og sikkert drikkevand, fælles forskning fra Monash University, CSIRO og University of Texas i Austin offent -
 Vanddråber som miniaturiserede reagensglasVæsker arrangerer sig selv i de mindste dråber på en DMA. Kredit:KIT Forskere fra Karlsruhe Institute of Technology (KIT) har udviklet laboratorieudstyr, der letter søgningen efter aktive stoffer
Vanddråber som miniaturiserede reagensglasVæsker arrangerer sig selv i de mindste dråber på en DMA. Kredit:KIT Forskere fra Karlsruhe Institute of Technology (KIT) har udviklet laboratorieudstyr, der letter søgningen efter aktive stoffer -
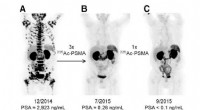 Hvordan forskere opdagede en ny måde at producere actinium-225, en sjælden medicinsk radioisotopDette billede viser tre forskellige billeder af en enkelt patient med prostatakræft i slutstadiet. Den første blev taget før behandling med actinium-225, den anden efter tre doser, og den tredje efter
Hvordan forskere opdagede en ny måde at producere actinium-225, en sjælden medicinsk radioisotopDette billede viser tre forskellige billeder af en enkelt patient med prostatakræft i slutstadiet. Den første blev taget før behandling med actinium-225, den anden efter tre doser, og den tredje efter
- Mælkevejenes oprindelse er ikke, hvad de ser ud til
- Andrew var et monster; Irma kunne blæse den op af vandet
- Fysikeren foreslår en måde at registrere lukkerhastigheder for kameraer, der glimter med molekyler
- Tricker bakterier til hydroxylerende benzen
- Endelig datafrigivelse fra DESI Legacy Imaging Surveys udgivet
- Forskere i Hong Kong baner nye veje inden for nanoteknologi


