Hvorfor er CsF mere opløseligt i vand end CsI?
1. Ionisk størrelse:Ionstørrelsen af fluorid (F-) ion er mindre sammenlignet med iodid (I-) ion. Den mindre størrelse af F-ionen giver mulighed for stærkere elektrostatiske interaktioner med de polære vandmolekyler, hvilket fører til bedre solvatisering og dermed højere opløselighed.
2. Hydrationsenergi:CsF's hydreringsenergi er større end CsI's. Hydrationsenergi refererer til den energi, der frigives, når ioner er omgivet af vandmolekyler. På grund af F-ionens mindre størrelse og højere ladningstæthed kan den interagere mere effektivt med vandmolekyler, frigive mere hydreringsenergi og resultere i højere opløselighed.
3. Gitterenergi:Gitterenergi er den energi, der kræves for at adskille ioner fra et krystalgitter. Generelt har forbindelser med lavere gitterenergier en tendens til at være mere opløselige. CsF har en lavere gitterenergi sammenlignet med CsI, hvilket gør det lettere for Cs+ og F-ionerne at dissociere og opløses i vand.
4. Polariserbarhed:Polariserbarhed måler en ions evne til at forvrænge sin elektronsky som reaktion på et eksternt elektrisk felt. Jodid-ionen (I-) er mere polariserbar end fluoridionen (F-), hvilket betyder, at den lettere kan deformeres i vand. Denne øgede polariserbarhed reducerer de elektrostatiske interaktioner mellem I- og Cs+ ioner, hvilket fører til svagere ionbindinger og lavere opløselighed.
Sammenfattende skyldes den højere opløselighed af CsF sammenlignet med CsI primært den mindre ionstørrelse, større hydreringsenergi, lavere gitterenergi og lavere polariserbarhed af fluoridionen (F-) sammenlignet med iodidionen (I-).
 Varme artikler
Varme artikler
-
 At presse et rockstjernet materiale kan gøre det stabilt nok til solcellerForskere ved SLAC National Accelerator Laboratory og Stanford University opdagede, at klemning af et lovende blyhalogenidmateriale i en diamantamboltcelle (til venstre) producerer en såkaldt sort pero
At presse et rockstjernet materiale kan gøre det stabilt nok til solcellerForskere ved SLAC National Accelerator Laboratory og Stanford University opdagede, at klemning af et lovende blyhalogenidmateriale i en diamantamboltcelle (til venstre) producerer en såkaldt sort pero -
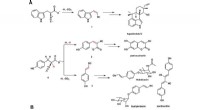 Forskere udforsker enzymer, der bruger en kation, ikke oxygen-addition, til at fremkalde reaktionerA) Hapalindol U, paerucumarin, rhabduscin og byelyankacin biosyntetiseres via 1, 2 eller 3 som nøglemellemprodukter. Jern- og 2-oxoglutarat-afhængige enzymer katalyserer decarboxyleringsassisteret des
Forskere udforsker enzymer, der bruger en kation, ikke oxygen-addition, til at fremkalde reaktionerA) Hapalindol U, paerucumarin, rhabduscin og byelyankacin biosyntetiseres via 1, 2 eller 3 som nøglemellemprodukter. Jern- og 2-oxoglutarat-afhængige enzymer katalyserer decarboxyleringsassisteret des -
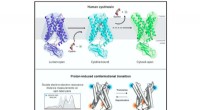 Undersøgelse afslører den molekylære oprindelse af den genetiske sygdom cystinoseStrukturelle og biofysiske undersøgelser af humant cystinosin afslører molekylære mekanismer og konformationel dynamik i protonkoblet lysosomal aminosyretransport. Kredit:Guo et al., Cell 2022 Den
Undersøgelse afslører den molekylære oprindelse af den genetiske sygdom cystinoseStrukturelle og biofysiske undersøgelser af humant cystinosin afslører molekylære mekanismer og konformationel dynamik i protonkoblet lysosomal aminosyretransport. Kredit:Guo et al., Cell 2022 Den -
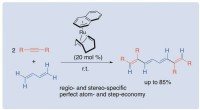 En effektiv tilgang til konjugerede tetraener fra butadien og alkynerEn ny one-pot tilgang af konjugerede tetraener fra 1, 3-butadien og to substituerede acetylener katalyseret af et nulvalent rutheniumkompleks. Kredit:Institut for Anvendt Kemi, Ingeniørskolen, Tokyo U
En effektiv tilgang til konjugerede tetraener fra butadien og alkynerEn ny one-pot tilgang af konjugerede tetraener fra 1, 3-butadien og to substituerede acetylener katalyseret af et nulvalent rutheniumkompleks. Kredit:Institut for Anvendt Kemi, Ingeniørskolen, Tokyo U
- Hvad er den kemiske ligning mellem magnesium og 6M HCl?
- Oplåsning af membranbaseret He/H₂-separation med AI
- stoffer i vandet? Giv ikke eleverne skylden
- Indflydelse af ekstremt vejr og geologi på tvangsvandringer i det sydlige Taiwan
- Hvordan man tegner isomerer for C6H12
- Sådan konverteres GPS-koordinater til Feet


