Undersøgelse afslører den molekylære oprindelse af den genetiske sygdom cystinose
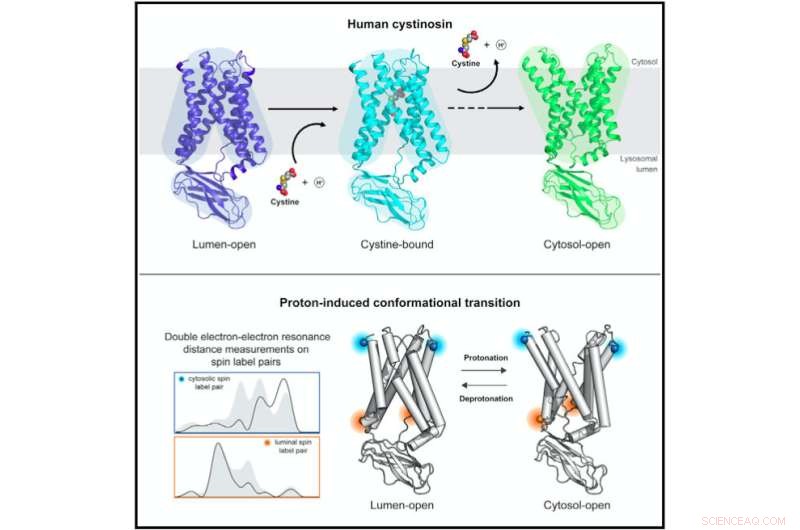
Strukturelle og biofysiske undersøgelser af humant cystinosin afslører molekylære mekanismer og konformationel dynamik i protonkoblet lysosomal aminosyretransport. Kredit:Guo et al., Cell 2022
Den sjældne genetiske sygdom cystinose er forårsaget af mutationer i genet for et protein kaldet cystinosin. Et team af videnskabsmænd har nu løst strukturen af cystinosin og fastslået, hvordan mutationer interfererer med dets normale funktion, hvilket giver indsigt i de underliggende mekanismer og foreslår en måde at udvikle nye behandlinger for sygdommen på.
Den nye undersøgelse, offentliggjort 15. september i Cell , involverede et samarbejde mellem forskere ved UC Santa Cruz, Stanford University og University of Texas Southwestern Medical Center, som kombinerede deres ekspertise i tre specialiserede metoder til at studere proteinstruktur og funktion:røntgenkrystallografi, kryogen elektronmikroskopi (kryo- EM), og dobbelt elektron-elektron resonans (DEER).
"Dette papir kunne sætte en model for, hvordan man kombinerer disse tre områder, sammen med biokemiske assays, for hurtigt at indsnævre, hvordan et protein fungerer og identificere en terapeutisk strategi," sagde Glenn Millhauser, anerkendt professor og formand for kemi og biokemi ved UC Santa Cruz og en tilsvarende forfatter til papiret.
Cystinosin er et specialiseret transportprotein, der spiller en afgørende rolle i, hvordan celler håndterer den essentielle aminosyre cystein. Celler genbruger konstant proteiner og nedbryder dem til deres aminosyrer til brug ved opbygning af nye proteiner. Transportører som cystinosin flytter aminosyrerne ud af lysosomer - de cellulære rum, hvor proteiner nedbrydes - ind i cellen for at blive genbrugt. Når cystinosin ikke fungerer korrekt på grund af mutationer, opbygges en form for cystein (en dimer kaldet cystin) inde i lysosomerne.
Den unormale ophobning af cystin forårsager udbredt skade på væv og organer og kan føre til nyresvigt, muskelsvind og andre problemer.
"Det er en sjælden sygdom, men den kan være dødelig," sagde Millhauser. "Hvis det er ubehandlet, dør mennesker med cystinose normalt i en alder af ti."
Cystinosin antager forskellige konformationer, når det er åbent til indersiden af lysosomet for at belaste cystin, og når det er åbent til ydersiden for at frigive cystin. Forskerholdene ved Stanford (ledet af professor Liang Feng) og ved UT Southwestern (ledet af professor Xiaochun Li) løste strukturerne af cystinosin i disse forskellige strukturelle konformationer ved hjælp af røntgenkrystallografi og kryo-EM.
Forståelse af cystinosins strukturelle ændringer gennem transportprocessen krævede dog DEER-undersøgelserne udført af Millhausers laboratorium. DEER er en specialiseret magnetisk resonansteknik, der kan bruges til at bestemme, hvordan et protein ændrer sin form.
"Med det var vi i stand til at finde ud af mekanismen, der gør det muligt for cystinosin at skifte mellem disse forskellige tilstande, og vi kunne indsnævre, hvilke af proteinets aminosyrer, der drev overgangen," sagde Millhauser. "Nu kan vi se, hvordan mutationerne ændrer proteinets evne til at ændre form og pumpe cystin ud af lysosomet."
Disse nye indsigter i den molekylære mekanik af cystinosins transportaktivitet giver ikke kun en mere detaljeret forståelse af patogenesen af cystinose, men foreslår også en mulig terapeutisk strategi til behandling af sygdommen. "Det kan være muligt at øge transportaktiviteten af cystinosin ved at udvikle konformationsselektive små molekyler eller biologiske stoffer, der favoriserer en cytosol-åben konformation," skrev forfatterne.
En lignende tilgang kunne bruges til at målrette mod andre transporterproteiner, som er involveret i en lang række sygdomme. + Udforsk yderligere
Transporterprotein involveret i renal reabsorption af cystin
 Varme artikler
Varme artikler
-
 Sådan beregnes syretestforholdSyrtestforholdet eller hurtigforholdet evaluerer et virksomheds kortsigtede likviditet og beregnes ved at dividere kontanter plus likvide midler med kortfristede forpligtelser. Et forhold mellem én og
Sådan beregnes syretestforholdSyrtestforholdet eller hurtigforholdet evaluerer et virksomheds kortsigtede likviditet og beregnes ved at dividere kontanter plus likvide midler med kortfristede forpligtelser. Et forhold mellem én og -
 Forståelse af enzymkaskader er nøglen til forståelse af stofskifteLigesom myrer, et enzym følger sporet efterladt af det foregående. I dette tilfælde, det indledende substrat påvirkes af enzym A, efterlader et substrat, der er egnet til enzym B og på linjen. Kredit:
Forståelse af enzymkaskader er nøglen til forståelse af stofskifteLigesom myrer, et enzym følger sporet efterladt af det foregående. I dette tilfælde, det indledende substrat påvirkes af enzym A, efterlader et substrat, der er egnet til enzym B og på linjen. Kredit: -
 Hvordan ioner samler vandmolekyler omkring demBochums forskerhold:Gerhard Schwaab, Martina Havenith og Federico Sebastiani (fra venstre). Kredit:RUB, Marquard Ladede partikler i vandige opløsninger er altid omgivet af en skal af vandmolekyler
Hvordan ioner samler vandmolekyler omkring demBochums forskerhold:Gerhard Schwaab, Martina Havenith og Federico Sebastiani (fra venstre). Kredit:RUB, Marquard Ladede partikler i vandige opløsninger er altid omgivet af en skal af vandmolekyler -
 Forskning baner vejen for stærkere legeringerForskningen beskriver, hvordan mikroskopiske krystaller vokser og ændrer form i smeltede metaller, når de afkøles. Kredit:Maksim Gusev Forskere fra University of Birmingham har beskrevet, hvordan m
Forskning baner vejen for stærkere legeringerForskningen beskriver, hvordan mikroskopiske krystaller vokser og ændrer form i smeltede metaller, når de afkøles. Kredit:Maksim Gusev Forskere fra University of Birmingham har beskrevet, hvordan m
- Hvordan bevæger ormene sig?
- Sådan beregnes Linearitet
- Har du nogensinde kæmpet med en Rubiks Cube? Nogen har skabt en, der løser sig selv
- Ikonisk plantefamilie i fare:Forskere vurderer, at mere end halvdelen af palmearterne kan være tr…
- Lorena lander i det sydvestlige Mexico som kategori 1 -orkan
- Sputnik, den lille kugle, der lancerede rumkapløbet (Opdatering)


