Hvordan ioner samler vandmolekyler omkring dem

Bochums forskerhold:Gerhard Schwaab, Martina Havenith og Federico Sebastiani (fra venstre). Kredit:RUB, Marquard
Ladede partikler i vandige opløsninger er altid omgivet af en skal af vandmolekyler. Imidlertid, meget er stadig ukendt om arten af denne såkaldte hydreringsskal. Ved hjælp af terahertz spektroskopi, kemikere fra Bochum har fået ny indsigt i, hvordan en ion påvirker vandmolekylerne i sit miljø. Prof Dr. Martina Havenith, Dr. Gerhard Schwaab og Dr. Federico Sebastiani fra Chair of Physical Chemistry II ved Ruhr-Universität Bochum (RUB) giver et overblik over resultaterne af eksperimenterne i tidsskriftet Angewandte Chemie i juli 2018.
"Ionernes hydreringsskal er ekstremt vigtigt for at forstå grundlæggende processer såsom transport af ioner gennem membraner eller batterier, " siger Martina Havenith, talsmand for Cluster of Excellence Ruhr Explores Solvation. "Imidlertid, tilsyneladende simple spørgsmål, som størrelsen af hydreringsskallen eller forekomsten af ionpardannelse, stadig ubesvaret."
Nye spektroskopiske metoder udviklet
På Ruhr-Universität Bochum, Martina Haveniths team nærmer sig dette spørgsmål med spektroskopiske metoder udviklet internt. Forskerne sender korte impulser af stråling i terahertz-området, altså med en bølgelængde lige under en millimeter, gennem prøven. Blandingen absorberer strålingen i forskellige grader i forskellige frekvensområder, som synliggøres i form af et spektrum. Spektret, dvs. absorptionsmønsteret, afslører noget om bevægelsen af visse bindinger i de undersøgte molekyler, fx om brintbindinger i et vandnetværk.
Bochum-gruppen udviklede specielle teknikker ved hjælp af lavfrekvent terahertz-stråling til at bestemme størrelsen af hydreringsskallen, altså antallet af vandmolekyler, der påvirkes af en ion. De nedbryder matematisk det registrerede absorptionsmønster til dets komponenter og kan dermed identificere de dele i spektret, der afslører noget om individuelle ioner eller par af ioner.
Opløsning af vandmolekyler i hydreringsskal
Resultatet:Hydreringsskaller med en størrelse mellem to og 21 vandmolekyler blev bestemt for mere end 37 undersøgte salte. Antallet afhænger f.eks. af ionens størrelse og dens valens. Enkeltladede ioner påvirker normalt færre vandmolekyler end flerladede ioner. "Imidlertid, dette er ikke helt systematisk, men afhænger også af den tilstedeværende kation eller anion, " forklarer Martina Havenith.
Forskerne bruger deres metode til at bestemme det såkaldte effektive antal vandmolekyler, som er det mindste antal vandmolekyler, der påvirkes af en ion, dvs. der ikke kan bevæge sig så frit som det upåvirkede omgivende vand. På grund af den positive eller negative ladning af en ion, vandmolekylerne med deres delvist positivt ladede brintatomer eller deres delvist negativt ladede iltatom retter sig efter ionen. "Ionens effekt på vandmolekylerne aftager gradvist med afstanden, Havenith forklarer. "Der er således ikke altid en klar grænse mellem påvirkede og upåvirkede vandmolekyler." Holdet specificerer derfor et minimumstal for størrelsen af hydreringsskallen.
Ionpar studeret
Imidlertid, Bochum-gruppen beskæftigede sig ikke kun med individuelle ioner, men også med par af kationer og anioner. Vandmolekylerne påvirker dannelsen af ionparret. De kan enten danne en fælles hydreringsskal omkring de to partnere eller separate skaller omkring kation og anion. Holdet er i stand til at estimere, hvor mange vandmolekyler disse skaller hver består af. "For at vide, hvor mange vandmolekyler der omgiver et jernchlorid, det er ikke nok at vide, hvor mange vandmolekyler, der påvirkes af en enkelt chloridion, og hvor mange af en enkelt jernion, " forklarer Havenith. Dette er ikke en simpel additiv proces.
"Generelt, vores resultater viser tydeligt, at samarbejdseffekter snarere end individuelle ionegenskaber er afgørende, " opsummerer forskeren. Det er derfor ikke nok at kende en enkelt ionegenskab for at forudsige, hvordan et salt vil påvirke vandmolekylerne i sit miljø. I stedet forskellige parametre, såsom ladningstætheden eller kombinationen af kation-anionen vil bestemme, om der dannes et ionpar.
 Varme artikler
Varme artikler
-
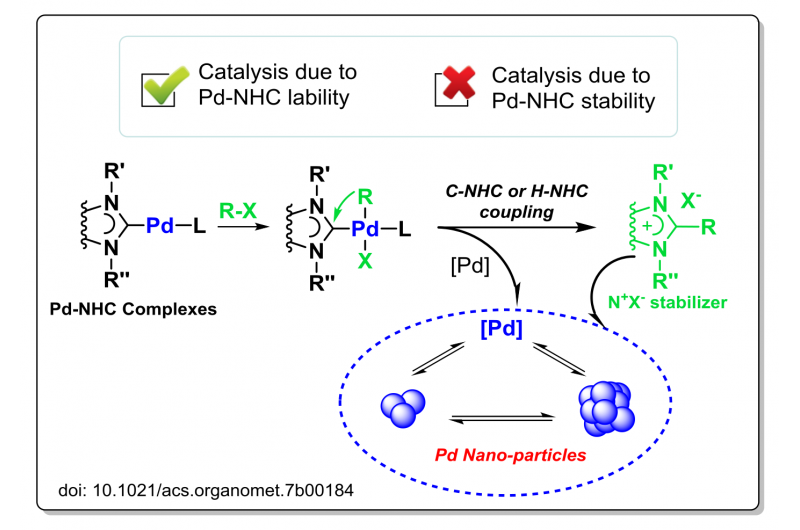 Let nedbrydning af metal-NHC-komplekser under katalytiske betingelser og nøglerollen for NHC-stabil…Substratformidlet nedbrydning af Pd-NHC-komplekser under katalytiske betingelser. Kredit:Zelinsky Institute of Organic Chemistry Metalkomplekser, der bærer N-heterocykliske carben-ligander (NHC-li
Let nedbrydning af metal-NHC-komplekser under katalytiske betingelser og nøglerollen for NHC-stabil…Substratformidlet nedbrydning af Pd-NHC-komplekser under katalytiske betingelser. Kredit:Zelinsky Institute of Organic Chemistry Metalkomplekser, der bærer N-heterocykliske carben-ligander (NHC-li -
 Gennembrud i makromolekylære maskiner til aktivt kontrolleret levering af kræftmedicinMolekylære maskiners kemiske struktur. Kredit:HKBU Forskere fra Hong Kong Baptist University (HKBU) demonstrerede design og syntese af et smart globulært makromolekylært maskinkøretøj til aktivt k
Gennembrud i makromolekylære maskiner til aktivt kontrolleret levering af kræftmedicinMolekylære maskiners kemiske struktur. Kredit:HKBU Forskere fra Hong Kong Baptist University (HKBU) demonstrerede design og syntese af et smart globulært makromolekylært maskinkøretøj til aktivt k -
 Kan vi helbrede kræft ved at finde ud af, hvordan to proteiner interagerer?Kredit:CC0 Public Domain I et papir offentliggjort i Journal of Biological Chemistry , Dr. Özdemir har undersøgt to proteinfamilier ved navn Rho GTPases og IQGAPer, som vides at spille en vigtig
Kan vi helbrede kræft ved at finde ud af, hvordan to proteiner interagerer?Kredit:CC0 Public Domain I et papir offentliggjort i Journal of Biological Chemistry , Dr. Özdemir har undersøgt to proteinfamilier ved navn Rho GTPases og IQGAPer, som vides at spille en vigtig -
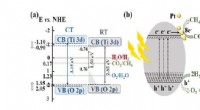 Ny fotokatalysator fremskynder omdannelsen af kuldioxid til kemiske ressourcerEt skematisk diagram, der viser mekanismen for omdannelsen af kuldioxid til metan ved hjælp af det reducerede titaniumdioxid udviklet af holdet. Kredit:DGIST Kuldioxid er en væsentlig årsag til
Ny fotokatalysator fremskynder omdannelsen af kuldioxid til kemiske ressourcerEt skematisk diagram, der viser mekanismen for omdannelsen af kuldioxid til metan ved hjælp af det reducerede titaniumdioxid udviklet af holdet. Kredit:DGIST Kuldioxid er en væsentlig årsag til
- Bluetooth-implementeringsproblem rejst af team, der udforsker sporing
- Forskere opdagede, hvilke gener der forårsager uoverkommeligt hårsyndrom
- Gør omfattende modellering af vandressourcer mere tilgængelig
- Facebook -chef er vært for konservative gæster midt i partiskabelse
- Forebyggelse af giftige arbejdsmiljøer gennem etisk ledelse
- Brug af maskinlæring til at rekonstruere forringede Van Gogh-tegninger


