Hvad er den mindste mængde vand, der skal til for at opløse 3mol kaliumdichromat?
For at bestemme den mindste mængde vand, der kræves, kan vi opsætte en andel:
(Masse af kaliumdichromat) / (Opløselighed) =(Masse af vand) / 100
Erstatning af de givne værdier:
(3 mol * 294,18 g/mol) / (12,5 g / 100 g) =(Vandmasse) / 100
Løsning for massen af vand:
Vandmasse =(3 mol * 294,18 g/mol) * (100 g / 12,5 g) =7058,4 g
Derfor er den mindste mængde vand, der er nødvendig for at opløse 3 mol kaliumdichromat, cirka 7058,4 g eller 7,058 kg.
Sidste artikelHvor mange grundstoffer er der i et fluoratom?
Næste artikelHvad er ladningen af dichromat?
 Varme artikler
Varme artikler
-
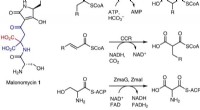 Forskere opdager en ny vej til antibiotika ved hjælp af genredigeringen, Malonomycin 1 indeholder en intakt aminomalonatdel. b, Biosyntese af malonater i primær og sekundær metabolisme (R = H eller alkyl). c, Foreslået mekanisme af pattedyret VKDC. Phylloquinoner (vita
Forskere opdager en ny vej til antibiotika ved hjælp af genredigeringen, Malonomycin 1 indeholder en intakt aminomalonatdel. b, Biosyntese af malonater i primær og sekundær metabolisme (R = H eller alkyl). c, Foreslået mekanisme af pattedyret VKDC. Phylloquinoner (vita -
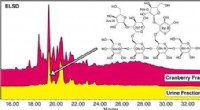 Tranebæroligosaccharider kan hjælpe med at forhindre UVIKredit:American Chemical Society Mange mennesker har hørt, at at drikke tranebærjuice kan hjælpe med at forhindre urinvejsinfektioner (UVI). Selvom kliniske forsøg med dette populære folkemiddel h
Tranebæroligosaccharider kan hjælpe med at forhindre UVIKredit:American Chemical Society Mange mennesker har hørt, at at drikke tranebærjuice kan hjælpe med at forhindre urinvejsinfektioner (UVI). Selvom kliniske forsøg med dette populære folkemiddel h -
 Kemikere rapporterer biofornyelig, biologisk nedbrydeligt plastalternativKredit:CC0 Public Domain Colorado State University polymerkemikere har taget endnu et skridt mod en fremtid med høj ydeevne, biofornybar, biologisk nedbrydelig plast. Udgiver i Naturkommunikatio
Kemikere rapporterer biofornyelig, biologisk nedbrydeligt plastalternativKredit:CC0 Public Domain Colorado State University polymerkemikere har taget endnu et skridt mod en fremtid med høj ydeevne, biofornybar, biologisk nedbrydelig plast. Udgiver i Naturkommunikatio -
 Forskere udvikler hurtigere test for hashkvalitetKredit:CC0 Public Domain Med den kommende legalisering af cannabis i Canada, producenter leder i stigende grad efter hurtige og præcise midler til at bestemme deres produkters styrke og kvalitet.
Forskere udvikler hurtigere test for hashkvalitetKredit:CC0 Public Domain Med den kommende legalisering af cannabis i Canada, producenter leder i stigende grad efter hurtige og præcise midler til at bestemme deres produkters styrke og kvalitet.
- Hvilke typer bindinger danner aktinider?
- Forklar i generelle vendinger, hvordan redoxreaktioner er involveret i energiudvekslinger?
- Mobile enheder reducerer ikke fælles familietid, undersøgelse finder
- Skræddersy nanokomposit-grænseflader med grafen for at opnå høj styrke og sejhed
- Hvilken lysfarve absorberer planter?
- Hydrogeler viser løfte som en ny måde at levere lægemidler mere effektivt på


