Hvad betyder en ren kovalent binding?
I modsætning til ionbindinger, hvor elektroner tydeligt overføres fra et atom til et andet, har begge atomer i en ren kovalent binding en lige stor andel af elektronparret. De dannes normalt kun, når elektronegativitetsforskellen mellem de to atomer er meget lille.
Nogle eksempler på rene kovalente bindinger er:
* Brint (H-H)
* Klor (Cl-Cl)
* Ilt (O-O)
* Metan (CH4)
* Ethan (C2H6)
Disse bindinger er kendt for deres høje styrke, da de holdes sammen af den stærke elektrostatiske tiltrækning mellem de positivt ladede kerner og de negativt ladede elektroner i bindingsparret.
Sidste artikelHvilket grundstof har elektronkonfigurationen 1s22s22p63s2?
Næste artikelHvad er trusiat af sodavand?
 Varme artikler
Varme artikler
-
 Brint:fremtidens brændstof?Da løbet om at finde energikilder til at erstatte vores faldende fossile brændstofforsyninger fortsætter i hast, brint vil sandsynligvis spille en afgørende rolle i fremtiden. Kredit:Materials Researc
Brint:fremtidens brændstof?Da løbet om at finde energikilder til at erstatte vores faldende fossile brændstofforsyninger fortsætter i hast, brint vil sandsynligvis spille en afgørende rolle i fremtiden. Kredit:Materials Researc -
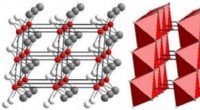 Mineralopdagelse gjort nemmere:Røntgenteknik kaster nyt lys på bittesmå, sjældne krystallerDisse diagrammer viser atomkrystalstrukturen af ognitit. Til venstre, atomer i den krystallinske struktur er repræsenteret i rødt (nikkel), hvid (tellur), og grå (vismut). Til højre, en polyhedral r
Mineralopdagelse gjort nemmere:Røntgenteknik kaster nyt lys på bittesmå, sjældne krystallerDisse diagrammer viser atomkrystalstrukturen af ognitit. Til venstre, atomer i den krystallinske struktur er repræsenteret i rødt (nikkel), hvid (tellur), og grå (vismut). Til højre, en polyhedral r -
 En ny måde at fremstille MXene-film på, der blokerer for elektromagnetisk interferensMed boomet i bærbar elektronik, Internet of Things-enheder og mere, belægninger, der blokerer for elektromagnetisk stråling, er ved at blive en kritisk del af fremstillingsprocessen. Andre ́ D. Taylor
En ny måde at fremstille MXene-film på, der blokerer for elektromagnetisk interferensMed boomet i bærbar elektronik, Internet of Things-enheder og mere, belægninger, der blokerer for elektromagnetisk stråling, er ved at blive en kritisk del af fremstillingsprocessen. Andre ́ D. Taylor -
 Giv den plasmabehandlingen:Stærk vedhæftning uden klæbemidlerFotografi af tre-lags samlinger af (a) PTFE/PDMS/Cu, (b) PTFE/PDMS/SUS430, og (c) PTFE/PDMS/glas. Når PTFE- eller PDMS-arket blev rykket og rystet, der forekom ingen afskalning ved grænsefladerne på P
Giv den plasmabehandlingen:Stærk vedhæftning uden klæbemidlerFotografi af tre-lags samlinger af (a) PTFE/PDMS/Cu, (b) PTFE/PDMS/SUS430, og (c) PTFE/PDMS/glas. Når PTFE- eller PDMS-arket blev rykket og rystet, der forekom ingen afskalning ved grænsefladerne på P
- ESO-observationer viser, at den første interstellare asteroide ligner intet før
- Lagring af lyn inde i torden:Forskere forvandler optiske data til læsbare lydbølger
- Kan revegetation returnere solcelleanlægsjord til sin uberørte herlighed?
- Hvordan nanoplast kan påvirke stofskiftet
- Boeing Starliner-astronauter:Hvad seks måneder fast i rummet kan gøre ved deres opfattelse af tid
- Offshore vindkraft sæt til 15-dobling:IEA


