Hvordan påvirker ionbinding forbindelsers egenskaber?
1. Krystalstruktur: Ioniske forbindelser danner typisk krystaller med et højt ordnet og regelmæssigt arrangement af ioner. Dette arrangement er drevet af den elektrostatiske tiltrækning mellem positivt ladede kationer og negativt ladede anioner, hvilket fører til dannelsen af ioniske krystaller.
2. Smelte- og kogepunkter: Ioniske forbindelser har generelt høje smelte- og kogepunkter på grund af de stærke elektrostatiske kræfter, der holder ionerne sammen. At overvinde disse kræfter kræver en betydelig mængde energi, hvilket resulterer i højere smelte- og kogepunkter.
3. Opløselighed: Ioniske forbindelser udviser varierende opløselighed i forskellige opløsningsmidler. De er generelt opløselige i polære opløsningsmidler, såsom vand, fordi de polære opløsningsmiddelmolekyler kan interagere med de ladede ioner og bryde iongitteret fra hinanden. Imidlertid er ioniske forbindelser normalt uopløselige i ikke-polære opløsningsmidler som hexan, som mangler den nødvendige polaritet til at overvinde den ioniske tiltrækning.
4. Elektrisk ledningsevne: I deres faste tilstand er ionforbindelser dårlige ledere af elektricitet, fordi ionerne holdes i faste positioner i krystalgitteret. Men når de opløses i vand eller smeltes, opløses ioniske forbindelser til frie ioner, hvilket tillader dem at bevæge sig og bære en elektrisk ladning, hvilket gør dem til gode ledere af elektricitet i disse tilstande.
5. Hårdhed: På grund af de stærke ioniske bindinger har ioniske forbindelser tendens til at være hårde og skøre. Den stive krystalstruktur og vanskeligheden ved at bryde ionbindingerne bidrager til deres hårdhed. Men denne stivhed gør dem også modtagelige for at knuses eller knække under mekanisk belastning.
6. Kemisk reaktivitet: Ionforbindelser deltager i kemiske reaktioner primært gennem ionbytning eller dannelse af nye ionbindinger. De kan gennemgå forskellige reaktioner, såsom udfældning, syre-basereaktioner og redoxreaktioner, afhængigt af arten af de involverede ioner.
7. Hygroskopicitet: Nogle ioniske forbindelser udviser hygroskopicitet, hvilket betyder, at de let absorberer fugt fra atmosfæren. Denne egenskab observeres ofte i ioniske forbindelser, der indeholder små og højt ladede ioner, som har en høj affinitet til vandmolekyler.
At forstå de egenskaber, der bibringes af ionbinding er afgørende for at forudsige adfærden og anvendelsen af ioniske forbindelser inden for forskellige områder, såsom kemi, materialevidenskab, teknik og farmaceutiske produkter.
Sidste artikelHvad er reaktionen mellem svovlchlorid og natriumhydroxid?
Næste artikelHvordan får en videnskabsmand fluor?
 Varme artikler
Varme artikler
-
 Kemikere udvikler en enkel, let at bruge metode til at nedbryde forurenende stoffer i vandKredit:George Hodan/public domain Kemikere fra Martin Luther University Halle-Wittenberg (MLU) har bestemt, hvordan genstridige forurenende stoffer i vand let kan opløses og omkostningseffektivt.
Kemikere udvikler en enkel, let at bruge metode til at nedbryde forurenende stoffer i vandKredit:George Hodan/public domain Kemikere fra Martin Luther University Halle-Wittenberg (MLU) har bestemt, hvordan genstridige forurenende stoffer i vand let kan opløses og omkostningseffektivt. -
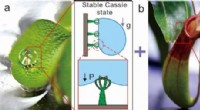 En ny salvinia-lignende glat overfladeDesign af den Salvinia-lignende glatte overflade. (a) Salvinia molesta flydende blad, hvor vanddråbe viser stabil Cassie-tilstand. Selvom det rationelle design af elastisk æggepiskerformet mikrostrukt
En ny salvinia-lignende glat overfladeDesign af den Salvinia-lignende glatte overflade. (a) Salvinia molesta flydende blad, hvor vanddråbe viser stabil Cassie-tilstand. Selvom det rationelle design af elastisk æggepiskerformet mikrostrukt -
 Forskning i nitrogenfiksering kunne kaste lys over biologisk mystikGødning tilføres en landbrugsmark. Kredit:SoilScience.info (CC BY 2.0) Inspireret af en naturlig proces fundet i visse bakterier, et hold af Caltech-forskere rykker tættere på en ny metode til at
Forskning i nitrogenfiksering kunne kaste lys over biologisk mystikGødning tilføres en landbrugsmark. Kredit:SoilScience.info (CC BY 2.0) Inspireret af en naturlig proces fundet i visse bakterier, et hold af Caltech-forskere rykker tættere på en ny metode til at -
 Forskere søger svamp for at belyse kræftKandidatstuderende Ananya Sengupta (l) og adjunkt i kemi og biokemi James Frederich fandt ud af, at et produkt afledt af en svamp kunne kaste lys over cellulære interaktioner fremtrædende i cancer. Kr
Forskere søger svamp for at belyse kræftKandidatstuderende Ananya Sengupta (l) og adjunkt i kemi og biokemi James Frederich fandt ud af, at et produkt afledt af en svamp kunne kaste lys over cellulære interaktioner fremtrædende i cancer. Kr
- Det britiske Oscar-vindende special effect-firma overvejer børsnotering i London
- Sådan beregnes en Bell Curve
- Entropimålinger afslører eksotisk effekt i magisk vinkelgrafen
- Plastikforurening er overalt. Undersøgelse afslører, hvordan den rejser
- Særlig relativitet, hvordan virker
- Lidt af et kvantemagic trick - eksperiment viser, hvordan man kan fremskynde frekvensmåling


