Hvordan er kogende fordampning det samme?
Den vigtigste forskel mellem de to er den temperatur, ved hvilken væsken ændres til en gas.
* Fordampning opstår, når en væskes temperatur er under kogepunktet. Væskens molekyler får energi fra det omgivende miljø og undslipper fra væskens overflade og bliver til en gas.
* Kogning opstår, når temperaturen af en væske når sit kogepunkt. Ved denne temperatur har væskens molekyler energi nok til at undslippe fra væskens overflade og inde fra selve væsken for at blive en gas.
En anden forskel mellem kogning og fordampning er hastigheden, hvormed væsken bliver til en gas .
* Fordampning er en langsom proces, mens kogning er en hurtig proces. Dette skyldes, at fordampning kun sker ved væskens overflade, mens kogning sker i hele væsken.
Endelig er en væskes kogepunkt afhængig af væskens tryk.
* Jo højere tryk, jo højere kogepunkt for væsken. Dette skyldes, at væskens tryk forhindrer væskens molekyler i at undslippe fra væskens overflade.
Sammenfattende er kogning og fordampning begge processer, hvor en væske bliver til en gas. Den vigtigste forskel mellem de to er den temperatur, hvor væsken ændres til en gas.
Sidste artikelHvordan fjerner opvarmet kobber ilt fra luften?
Næste artikelHvad er ti kemiske stoffer i supermarkedet?
 Varme artikler
Varme artikler
-
 Sådan bukker du fladt glas perfekt rundt om hjørnerEt dobbeltglas hjørneelement produceret med den nye glasbukkeproces. Kredit:Fraunhofer IWM Forskere fra Fraunhofer Institute for Mechanics of Materials IWM har udviklet en ny proces, der kan bøje
Sådan bukker du fladt glas perfekt rundt om hjørnerEt dobbeltglas hjørneelement produceret med den nye glasbukkeproces. Kredit:Fraunhofer IWM Forskere fra Fraunhofer Institute for Mechanics of Materials IWM har udviklet en ny proces, der kan bøje -
 Våd-tør-cyklusser kunne have tilladt syntese af byggesten til RNA på den tidlige jordKredit:CC0 Public Domain Et team af forskere med medlemmer fra institutioner i Tyskland, Storbritannien og Japan har udviklet en ny teori for at forklare, hvordan RNA kunne have stammer fra den ti
Våd-tør-cyklusser kunne have tilladt syntese af byggesten til RNA på den tidlige jordKredit:CC0 Public Domain Et team af forskere med medlemmer fra institutioner i Tyskland, Storbritannien og Japan har udviklet en ny teori for at forklare, hvordan RNA kunne have stammer fra den ti -
 Fremstilling af nye materialer ved hjælp af kunstig intelligensKredit:Pohang University of Science &Technology (POSTECH) Der er et gammelt ordsprog, Hvis gummi er det materiale, der åbnede vejen til jorden, aluminium er den, der åbnede vejen til himlen. Nye m
Fremstilling af nye materialer ved hjælp af kunstig intelligensKredit:Pohang University of Science &Technology (POSTECH) Der er et gammelt ordsprog, Hvis gummi er det materiale, der åbnede vejen til jorden, aluminium er den, der åbnede vejen til himlen. Nye m -
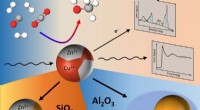 Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge
Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge
- Smog vender tilbage til den indiske hovedstad, da landbrugsbrande starter
- Røntgenstråler kan være en bedre måde at kommunikere i rummet på
- Blandinger af dækafgrøder skal være afstemt på bedriften for at levere maksimale økosystemtjene…
- Hvordan klimaændringer fremmede overgangen fra nomadiske jæger-samlere til bosættelses- og landbr…
- Hvor mange atomer i 2 NaOH?
- Tag en 3D-tur på Mars, og følg NASAs Perseverance-rover


