Hvorfor har N2 lavere kogepunkt end CO?
De intermolekylære kræfter mellem molekyler er forårsaget af tiltrækningen mellem de positive og negative ladninger i molekylerne.
Nitrogen (N2) er et upolært molekyle, hvilket betyder, at elektronerne er jævnt fordelt rundt om molekylet, og der er ingen netto positiv eller negativ ladning.
På den anden side er kulilte (CO) et polært molekyle, hvilket betyder, at elektronerne ikke er jævnt fordelt rundt om molekylet, og der er en netto positiv ladning på kulstofatomet og en netto negativ ladning på oxygenatomet.
Den polære natur af CO skaber stærkere intermolekylære kræfter end den ikke-polære natur af N2. De stærkere intermolekylære kræfter mellem CO-molekyler får dem til at klæbe tættere sammen end N2-molekyler, hvilket betyder, at der skal mere energi til for at bryde de intermolekylære kræfter og koge CO end N2. Derfor har CO et højere kogepunkt end N2.
Kogepunktet er den temperatur, hvor damptrykket af en væske er lig med trykket omkring væsken, og væsken ændres til en damp. En væskes kogepunkt er direkte relateret til styrken af de intermolekylære kræfter mellem væskens molekyler. stærkere de intermolekylære kræfter, jo højere kogepunktet.
Sammenfattende har N2 et lavere kogepunkt end CO, fordi de intermolekylære kræfter mellem N2-molekyler er svagere end de intermolekylære kræfter mellem CO-molekyler.
Sidste artikelHvorfor stopper magnesium- og saltsyrereaktionen?
Næste artikelEr katronens stråler damp af elektron?
 Varme artikler
Varme artikler
-
 Superionisk forbindelse med det højeste brintindhold er succesfuldt forudsagt og udforsketSkematisk fremstilling af eksperimentet:Under et tryk på 100 gigapascal bliver en blanding af strontium- og brintmolekyler til stabil SrH22. Kredit:Wuhao Chen/Jilin University I samarbejde med fors
Superionisk forbindelse med det højeste brintindhold er succesfuldt forudsagt og udforsketSkematisk fremstilling af eksperimentet:Under et tryk på 100 gigapascal bliver en blanding af strontium- og brintmolekyler til stabil SrH22. Kredit:Wuhao Chen/Jilin University I samarbejde med fors -
 Gør bleer til klistermærker:Brug kemisk genbrug til at forhindre millioner af tons affaldKredit:Pixabay/CC0 Public Domain Hvert år, 3,5 millioner tons opblødte bleer ender på lossepladser. Det superabsorberende materiale inde i disse bleer består af en matrix af polymerer, der udvide
Gør bleer til klistermærker:Brug kemisk genbrug til at forhindre millioner af tons affaldKredit:Pixabay/CC0 Public Domain Hvert år, 3,5 millioner tons opblødte bleer ender på lossepladser. Det superabsorberende materiale inde i disse bleer består af en matrix af polymerer, der udvide -
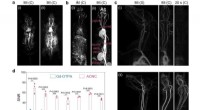 En simpel opskrift på MR-kontraster er op til fire gange højereIn vivo MR angiografi. a, b Kontrastforstærket MR-angiografi (MRA) billeder af hele kroppen på en rotte og b kanin umiddelbart efter bolusinjektionen af (i) Gd-DTPA og (ii) ACNC. c MRA-billeder af o
En simpel opskrift på MR-kontraster er op til fire gange højereIn vivo MR angiografi. a, b Kontrastforstærket MR-angiografi (MRA) billeder af hele kroppen på en rotte og b kanin umiddelbart efter bolusinjektionen af (i) Gd-DTPA og (ii) ACNC. c MRA-billeder af o -
 Venstre eller højre molekyler giver en hånd til materielle strukturerEn rekonstruktion af blokcopolymerer set gennem et elektronmikroskop viser tydeligt, hvordan de følger chiraliteten, eller håndfasthed, etableret af deres grundlæggende molekyler og vokser til spiralf
Venstre eller højre molekyler giver en hånd til materielle strukturerEn rekonstruktion af blokcopolymerer set gennem et elektronmikroskop viser tydeligt, hvordan de følger chiraliteten, eller håndfasthed, etableret af deres grundlæggende molekyler og vokser til spiralf
- Hvordan forhindrer man oxidation i en kuglemølle?
- Hvordan ufuldkommenheder faktisk kan forbedre legeringer
- Skin et lys:Ny forskning viser, hvordan lavenergilys kan bøje plastik
- Kan du virkelig knuse et glas med høj tone?
- Elektronkrystallografi viste sig at virke lige så godt som røntgenkrystallografi kun på mindre kr…
- Hvad er studiet af forhold mellem levende ting og deres miljø og hinanden?


