Hvorfor stopper magnesium- og saltsyrereaktionen?
1. Begrænsende reaktant: Hvis en af reaktanterne er til stede i en begrænset mængde, vil reaktionen til sidst stoppe, når den reaktant er forbrugt. Hvis du for eksempel har et lille stykke magnesium og et overskud af saltsyre, vil reaktionen fortsætte, indtil alt magnesium er opløst.
2. Koncentration: Koncentrationen af reaktanterne kan påvirke reaktionshastigheden. Højere koncentrationer fører generelt til hurtigere reaktioner. Hvis koncentrationen af enten magnesium eller saltsyre er for lav, kan reaktionen bremse betydeligt eller endda se ud til at stoppe.
3. Temperatur: Temperatur spiller også en rolle i reaktionshastigheder. Højere temperaturer fremskynder normalt reaktioner. Hvis temperaturen er for lav, kan reaktionen mellem magnesium og saltsyre være meget langsom eller endda umærkelig.
4. Urenheder eller hæmmere: Tilstedeværelsen af urenheder eller inhibitorer kan forstyrre reaktionen og bremse den. For eksempel, hvis magnesium indeholder urenheder, der danner et beskyttende lag på dets overflade, kan det hindre reaktionen med saltsyre. På samme måde kan visse forbindelser fungere som inhibitorer og reducere reaktionshastigheden.
5. Produkthæmning: I nogle tilfælde kan produkterne af en reaktion akkumulere og hæmme den videre udvikling af reaktionen. Til reaktionen mellem magnesium og saltsyre er produkterne magnesiumchlorid og hydrogengas. Hvis koncentrationen af magnesiumchlorid bliver for høj, kan det begynde at hæmme reaktionen.
Derfor, mens reaktionen mellem magnesium og saltsyre ikke stopper helt, kan forskellige faktorer få den til at bremse eller se ud til at stoppe. Forståelse af disse faktorer er afgørende for at kontrollere og optimere kemiske reaktioner i forskellige industri- og laboratoriemiljøer.
Sidste artikelI hvilken tilstand eksisterer klorelementet?
Næste artikelHvorfor har N2 lavere kogepunkt end CO?
 Varme artikler
Varme artikler
-
 Mikro-/nano-arkitekturer i MOF-membran fremskynder olie-vandseparation(en, b) SEM-billeder og (c) af AFM-billede ZIF-8-belagt mesh-membran; (d) Fotografiet af flere oliedråber på ZIF-8-belagt mesh-membran. Kredit:© Science China Press Hyppige olieudslip under olietr
Mikro-/nano-arkitekturer i MOF-membran fremskynder olie-vandseparation(en, b) SEM-billeder og (c) af AFM-billede ZIF-8-belagt mesh-membran; (d) Fotografiet af flere oliedråber på ZIF-8-belagt mesh-membran. Kredit:© Science China Press Hyppige olieudslip under olietr -
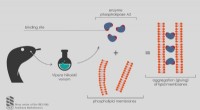 Kemikere opdagede, hvordan hugormegiften virkerKredit:Institut for Bioorganisk Kemi ved Det Russiske Videnskabsakademi Russiske videnskabsmænd rapporterer, at enzymet phospholipase A2 fra Vipera nikolskii-giften er i stand til at klæbe til lip
Kemikere opdagede, hvordan hugormegiften virkerKredit:Institut for Bioorganisk Kemi ved Det Russiske Videnskabsakademi Russiske videnskabsmænd rapporterer, at enzymet phospholipase A2 fra Vipera nikolskii-giften er i stand til at klæbe til lip -
 Forskere opdager, at molekyler spin flip fra magnetiske til ikke-magnetiske former dynamiskKredit:University of Missouri-Columbia En uventet opdagelse i professor Arthur Suits kemilaboratorium kunne få konsekvenser for fremstilling af mere effektive solceller og forbedring af fotodynami
Forskere opdager, at molekyler spin flip fra magnetiske til ikke-magnetiske former dynamiskKredit:University of Missouri-Columbia En uventet opdagelse i professor Arthur Suits kemilaboratorium kunne få konsekvenser for fremstilling af mere effektive solceller og forbedring af fotodynami -
 Fra at lave vin til at håndtere mineaffald, ler er vigtigt for mange industrierDe unikke egenskaber ved ler gør dem velegnede til en lang række anvendelser. Kredit:Shutterstock Opdagelsen og brugen af ler går tilbage til 30, 000 år siden, gør ler til et af de ældste materi
Fra at lave vin til at håndtere mineaffald, ler er vigtigt for mange industrierDe unikke egenskaber ved ler gør dem velegnede til en lang række anvendelser. Kredit:Shutterstock Opdagelsen og brugen af ler går tilbage til 30, 000 år siden, gør ler til et af de ældste materi
- Olie, hvordan raffinering fungerer
- Spinder antibakterielt sølv op på glas
- Vi kan bruge afviste tomater til at generere elektricitet,
- Hvor meget energi har et fast stof i sig?
- Hvad er tre ting, der bestemmer om en molekyle vil kunne diffusere over et cellemembran?
- En kæde i Mælkevejen forbundet med galaktisk kollision


