Hvad kan du bestemme om et atom baseret på dets atomradius?
1. Atomets størrelse:
Atomradius angiver direkte den samlede størrelse af et atom. Større atomradius svarer til større atomer, mens mindre atomradius angiver mindre atomer. Denne information er afgørende for at forstå de fysiske dimensioner af atomer og deres relative størrelser inden for det periodiske system.
2. Periodiske tendenser:
Atomradius udviser periodiske tendenser inden for det periodiske system. Bevæger man sig ned ad en gruppe (søjle) i tabellen, øges atomradierne generelt, fordi der tilføjes nye elektronskaller, hvilket fører til en stigning i atomets samlede størrelse. Omvendt, når man bevæger sig hen over en periode (række), falder atomradierne generelt fra venstre mod højre på grund af stigningen i effektiv kerneladning (den netto positive ladning, som elektronerne oplever), der trækker elektronerne tættere på kernen.
3. Ioniseringsenergi:
Atomradius er omvendt relateret til ioniseringsenergi. Ioniseringsenergi repræsenterer den energi, der kræves for at fjerne en elektron fra et atom. Mindre atomer med en mindre atomradius har en højere ioniseringsenergi, fordi elektronerne holdes tættere fast af den stærkere nukleare ladning. I modsætning hertil har større atomer med en større atomradius lavere ioniseringsenergi, da elektronerne er længere væk fra kernen og oplever svagere tiltrækningskræfter.
4. Elektronegativitet:
Elektronegativitet måler et atoms evne til at tiltrække elektroner mod sig selv, når det er kemisk bundet til et andet atom. Det er generelt omvendt relateret til atomradius. Atomer med en mindre atomradius har højere elektronegativitet på grund af den stærkere tiltrækning mellem kernen og elektronerne, mens atomer med en større atomradius har lavere elektronegativitet.
5. Metallisk karakter:
Metallisk karakter refererer til et grundstofs tendens til at donere elektroner og danne positive ioner. Det er generelt forbundet med større atomare radier. Grundstoffer med større atomradius har en tendens til at have lavere elektronegativitet og er mere villige til at opgive elektroner og udviser således en mere udtalt metallisk karakter.
6. Kemisk reaktivitet:
Atomradius påvirker et atoms kemiske reaktivitet. Mindre atomer med højere elektronegativitet og ioniseringsenergi er mindre reaktive sammenlignet med større atomer med lavere elektronegativitet og ioniseringsenergi. Mindre atomer har en tendens til at danne stærkere bindinger på grund af den stærkere elektrostatiske tiltrækning mellem deres kerner og elektroner.
Ved at forstå den atomare radius og dens forhold til forskellige atomare egenskaber og periodiske tendenser kan kemikere få indsigt i grundstoffernes adfærd og reaktivitet, hvilket gør dem i stand til at forudsige deres kemiske egenskaber og interaktioner.
 Varme artikler
Varme artikler
-
 Kulstof-elskende materialer designet til at reducere industrielle emissionerKredit:Oak Ridge National Laboratory Forskere ved Department of Energys Oak Ridge National Laboratory og University of Tennessee, Knoxville, fremmer gasmembranmaterialer for at udvide praktiske te
Kulstof-elskende materialer designet til at reducere industrielle emissionerKredit:Oak Ridge National Laboratory Forskere ved Department of Energys Oak Ridge National Laboratory og University of Tennessee, Knoxville, fremmer gasmembranmaterialer for at udvide praktiske te -
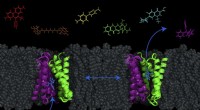 Ny model afslører muligheden for at pumpe antibiotika ind i bakterierEt transportørprotein - kaldet EmrE, vist i lilla og grønt -- i cellemembranen af E. coli kan bakterier skiftes mellem to konformationer for at pumpe molekyler (såsom antibakterielle lægemidler) ud
Ny model afslører muligheden for at pumpe antibiotika ind i bakterierEt transportørprotein - kaldet EmrE, vist i lilla og grønt -- i cellemembranen af E. coli kan bakterier skiftes mellem to konformationer for at pumpe molekyler (såsom antibakterielle lægemidler) ud -
 Video:Hvorfor durian er den ildelugtende konge af frugterKredit:The American Chemical Society Durian er kendt som frugternes konge i Sydøstasien, men det er også forbudt i mange offentlige rum på grund af dets kraftige lugt. Denne uges Reactions-video
Video:Hvorfor durian er den ildelugtende konge af frugterKredit:The American Chemical Society Durian er kendt som frugternes konge i Sydøstasien, men det er også forbudt i mange offentlige rum på grund af dets kraftige lugt. Denne uges Reactions-video -
 Nyt værktøj ændrer spillet for heterogen materialemodelleringNREL-forskerne Francois Usseglio-Viretta (til venstre) og Nicholas Brunhart-Lupo bruger 3D-visualiseringslaboratoriet i Insight Center på NRELs Energy Systems Integration Facility til at arbejde på Mi
Nyt værktøj ændrer spillet for heterogen materialemodelleringNREL-forskerne Francois Usseglio-Viretta (til venstre) og Nicholas Brunhart-Lupo bruger 3D-visualiseringslaboratoriet i Insight Center på NRELs Energy Systems Integration Facility til at arbejde på Mi
- Forskere adskiller vand effektivt med nye katalysatorer
- Hvordan væver en edderkop sit spind?
- Sunde organeller, sunde celler
- Udtalelse:Hvordan flaskevandsindustrien maskerer den globale krise
- Resonans: Definition, Typer, Frekvens og eksempler
- Evolutionsbiologer undersøger, hvordan plantekuldespecialister kan tilpasse sig miljøet


