Passer bunsenbrænderens kemiske REAKTION?
Her er den kemiske ligning for forbrænding af metan, som er den primære komponent af naturgas i Bunsen-brænderen:
CH4 + 2O2 -> CO2 + 2H2O
• Metan(CH4), reagerer med iltgas(O2) i luften under forbrænding.
Denne forbrændingsreaktion involverer
✓ Brud af kulstof-brintbindinger (CH) i metan.
✓ Dannelse af stærkere Carbon-Oxygen-bindinger (CO) og Hydrogen-Oxygen-bindinger (H2O).
Når der således slås en tændstik på bunsenbrænderen for at starte flammen, sker der en forbrændingsreaktion, der forårsager antændelse. Denne reaktion frigiver energi i form af varme og lys, hvilket gør det muligt for bunsenbrænderen at producere en stabil flamme til brug i laboratorier og videnskabelige omgivelser.
Sidste artikelEr der nogen, der har en GC-renhedsmetode for chloroform?
Næste artikelHvilke tre blandinger findes i en menneskekrop?
 Varme artikler
Varme artikler
-
 Papir uden mikroplast:En økonomisk og miljøvenlig belægningEn papirkop belagt med det nye MSU-materiale til venstre holder væske uden at lække, i modsætning til dens ubelagte modstykke til højre. Kredit:Muhammad Rabnawaz/Sustainable Materials Group Michig
Papir uden mikroplast:En økonomisk og miljøvenlig belægningEn papirkop belagt med det nye MSU-materiale til venstre holder væske uden at lække, i modsætning til dens ubelagte modstykke til højre. Kredit:Muhammad Rabnawaz/Sustainable Materials Group Michig -
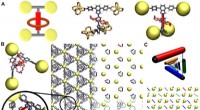 Fysikere afkoder den dynamiske interaktion mellem molekylære maskiner i metal-organiske rammerMolekylær struktur af den rotaxanfunktionaliserede MOF.(A ) Repræsentation af én organisk linker, der forbinder fire uorganiske Zn4 O hjørner. Det venstre billede skitserer byggestenens struktur, det
Fysikere afkoder den dynamiske interaktion mellem molekylære maskiner i metal-organiske rammerMolekylær struktur af den rotaxanfunktionaliserede MOF.(A ) Repræsentation af én organisk linker, der forbinder fire uorganiske Zn4 O hjørner. Det venstre billede skitserer byggestenens struktur, det -
 Åbning af nye døre:Første syntetiske mekanofølsomme kaliumkanalKredit:Kohei Sato, Tokyo Institute of Technology Forbløffet af egenskaberne af ionkanalproteiner, der almindeligvis observeres i celler, har Tokyo Tech-forskere udviklet den første syntetiske mekan
Åbning af nye døre:Første syntetiske mekanofølsomme kaliumkanalKredit:Kohei Sato, Tokyo Institute of Technology Forbløffet af egenskaberne af ionkanalproteiner, der almindeligvis observeres i celler, har Tokyo Tech-forskere udviklet den første syntetiske mekan -
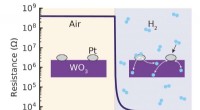 En brintsensor, der fungerer ved stuetemperaturKredit:Delft University of Technology Forskere ved TU Delft har udviklet en meget følsom og alsidig brintsensor, der fungerer ved stuetemperatur. Sensoren er lavet af et tyndt lag af et materiale
En brintsensor, der fungerer ved stuetemperaturKredit:Delft University of Technology Forskere ved TU Delft har udviklet en meget følsom og alsidig brintsensor, der fungerer ved stuetemperatur. Sensoren er lavet af et tyndt lag af et materiale
- Apple afslører ny $299 iPad til studerende – understøtter AR, Apple blyant
- Militære forskere ser ikke-dødelig rolle for talende lasere
- Klimaændringer:Besættelse af plastforurening distraherer opmærksomheden fra større miljøudfordr…
- Forskere udvikler grøn metode til fremstilling af bakteriedræbende kobberoxidnanopartikler fra non…
- Grundvandspolitikken fyrer op for luftforurening i det nordvestlige Indien
- Brændte bygninger afslører plyndringen af den gamle tyrkiske by 3, 500 år siden


