Hvad gør et opløsningsmiddel polært?
Et opløsningsmiddel betragtes som polært, hvis det har en netto positiv eller negativ ladning, eller hvis det indeholder funktionelle grupper med signifikante dipolmomenter. Flere faktorer bidrager til polariteten af et opløsningsmiddel:
1. Elektronegativitetsforskelle:Elektronegativiteten af atomer i opløsningsmiddelmolekylet kan skabe polære bindinger. Elektronegativitet er et atoms evne til at tiltrække elektroner mod sig selv. Når atomer med forskellige elektronegativiteter er bundet, deles elektronerne ulige, hvilket resulterer i en delvis positiv ladning på det ene atom og en delvis negativ ladning på det andet. Denne forskel i elektronegativitet skaber et dipolmoment.
2. Dipolmomenter:Dipolmomenter er vektorer, der repræsenterer størrelsen og retningen af ladningsadskillelsen i et molekyle. Den overordnede polaritet af et opløsningsmiddel afhænger af nettodipolmomentet af dets konstituerende molekyler. Opløsningsmidler med høje netto dipolmomenter er mere polære end dem med lave eller nul dipolmomenter.
3. Hydrogenbinding:Hydrogenbinding er en stærk dipol-dipol-interaktion, der opstår mellem et brintatom, der er kovalent bundet til et elektronegativt atom (såsom N, O eller F) og et andet elektronegativt atom. Hydrogenbinding kan i høj grad øge polariteten af et opløsningsmiddel ved at styrke de intermolekylære kræfter mellem dets molekyler.
4. Dielektrisk konstant:Dielektrisk konstant (ε) for et opløsningsmiddel er et mål for dets evne til at reducere den elektrostatiske kraft mellem ladede partikler. Polære opløsningsmidler har generelt højere dielektriske konstanter end ikke-polære opløsningsmidler. En høj dielektrisk konstant indikerer, at opløsningsmidlet effektivt kan opløse ioner eller andre ladede arter ved at reducere styrken af elektrostatiske interaktioner.
Eksempler på polære opløsningsmidler omfatter vand, alkoholer (såsom methanol, ethanol og isopropanol), dimethylformamid (DMF) og acetone. Disse opløsningsmidler har elektronegative atomer (O, N eller F), der skaber polære bindinger og kan deltage i hydrogenbinding. På den anden side har ikke-polære opløsningsmidler som hexan, benzen og toluen lave dielektriske konstanter og indeholder ikke signifikante dipolmomenter eller hydrogenbindingsevner.
Sammenfattende bestemmes polariteten af et opløsningsmiddel af tilstedeværelsen af elektronegative atomer, dipolmomenter og hydrogenbindingsevner i dets molekyler. Polære opløsningsmidler har en netto positiv eller negativ ladning eller indeholder funktionelle grupper med signifikante dipolmomenter, hvilket påvirker deres solvatiseringsegenskaber og interaktioner med andre molekyler.
Sidste artikelEr smurt popcorn en blanding eller blanding?
Næste artikelHvad beskriver bedst, hvad der sker i en kemisk reaktion?
 Varme artikler
Varme artikler
-
 Forebyggelse af tyktarmskræft og dødfødslerDr. Kirsten Wolthers arbejder i et laboratorium. Kredit:Canadian Light Source At karakterisere et lillebitte protein – bestemme dets form og hvad det gør – var det første skridt taget af Dr. Kirst
Forebyggelse af tyktarmskræft og dødfødslerDr. Kirsten Wolthers arbejder i et laboratorium. Kredit:Canadian Light Source At karakterisere et lillebitte protein – bestemme dets form og hvad det gør – var det første skridt taget af Dr. Kirst -
 Helikater møder rotaxaner for at skabe løfte om fremtidig sygdomsbehandlingKredit:University of Birmingham En ny tilgang til behandling af kræft og andre sygdomme, der bruger et mekanisk sammenlåst molekyle som en magisk kugle er designet af forskere ved University of Bi
Helikater møder rotaxaner for at skabe løfte om fremtidig sygdomsbehandlingKredit:University of Birmingham En ny tilgang til behandling af kræft og andre sygdomme, der bruger et mekanisk sammenlåst molekyle som en magisk kugle er designet af forskere ved University of Bi -
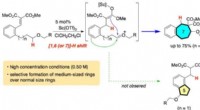 Forskere udvikler metode til at forbedre skelettet af almindelige kemikalierForskere i Japan udviklede en ny metode til at producere mere komplicerede og mellemstore (syv- og otte-leddede) carbocycles. Kredit:Keiji Mori, TUAT Ethvert kemikalie, fra det enkleste til det me
Forskere udvikler metode til at forbedre skelettet af almindelige kemikalierForskere i Japan udviklede en ny metode til at producere mere komplicerede og mellemstore (syv- og otte-leddede) carbocycles. Kredit:Keiji Mori, TUAT Ethvert kemikalie, fra det enkleste til det me -
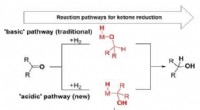 Metalhydrider med forbedret stabilitet i vandFigur viser de basiske og sure metalhydridveje for ketonreduktionsreaktionen. Alternative reaktionsveje for kendte reaktioner bidrager til forståelsen af katalytiske systemer, men giver også mulighe
Metalhydrider med forbedret stabilitet i vandFigur viser de basiske og sure metalhydridveje for ketonreduktionsreaktionen. Alternative reaktionsveje for kendte reaktioner bidrager til forståelsen af katalytiske systemer, men giver også mulighe
- Hvordan fungerer carbon capture?
- Hvad er tilpasningerne til, at dyr kan overleve i Taiga?
- Nye fund bringer fysikere tættere på at forstå dannelsen af planeter og stjerner
- Hvor mange elektroner har O?
- Facebooks dataoverførselssag i USA går til Europas øverste domstol
- Undersøgelse undersøger, hvor meget klimaændringer påvirker risikoen for væbnet konflikt


