Hvad reagerer bor på?
1. Reaktion med halogener:Bor reagerer med halogener og danner kovalente halogenider. For eksempel, når bor reagerer med fluorgas (F2), danner det bortrifluorid (BF3).
2. Reaktion med ilt:Ved opvarmning i luft eller i nærvær af iltgas danner bor forskellige oxider. For eksempel kan det reagere med oxygen og danne bortrioxid (B2O3) og forskellige andre bortoxider.
3. Reaktion med nitrogen:Bor reagerer med nitrogengas (N2) ved høje temperaturer og danner bornitrid (BN). Bornitrid har en lagdelt struktur, der ligner grafit og er en meget stabil forbindelse.
4. Reaktion med kulstof:Bor reagerer med kulstof og danner borcarbider. For eksempel reagerer det med kulstof ved høje temperaturer og danner borcarbid (B4C), et hårdt keramisk materiale med højt smeltepunkt.
5. Reaktion med metaller:Bor kan reagere med visse metaller og danne metalborider. For eksempel, når bor reagerer med aluminium, danner det aluminiumborid (AlB2), som bruges som et højtemperaturmateriale i rumfarts- og bilindustrien.
Bors reaktivitet kan variere afhængigt af temperaturen og reaktionsbetingelserne. Det er typisk et ikke-reaktivt grundstof ved stuetemperatur, men bliver mere reaktivt ved forhøjede temperaturer. Borreaktionerne er vigtige i forskellige industrier og anvendelser, herunder metallurgi, keramik, højtemperaturmaterialer, halvledere og kemisk syntese.
Sidste artikelHvordan reagerer bor på vand?
Næste artikelHvad er forbindelsen af NaClO2?
 Varme artikler
Varme artikler
-
 Video:Hvilken af disse svampe kan dræbe dig?Kredit:The American Chemical Society Der er titusindvis af svampearter derude, og nogle af dem kunne dræbe dig. I dag skal vi teste, hvor godt du kan adskille det helt sikre fra det farlige giftig
Video:Hvilken af disse svampe kan dræbe dig?Kredit:The American Chemical Society Der er titusindvis af svampearter derude, og nogle af dem kunne dræbe dig. I dag skal vi teste, hvor godt du kan adskille det helt sikre fra det farlige giftig -
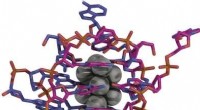 Bestemmelse af krystalstrukturen af en DNA-stabiliseret sølv nanoclusterKredit:Angewandte Chemie Nanoclusters er små dynger af nogle få atomer, der ofte har interessante optiske egenskaber og kan blive nyttige prober til billeddannelsesprocesser inden for områder som
Bestemmelse af krystalstrukturen af en DNA-stabiliseret sølv nanoclusterKredit:Angewandte Chemie Nanoclusters er små dynger af nogle få atomer, der ofte har interessante optiske egenskaber og kan blive nyttige prober til billeddannelsesprocesser inden for områder som -
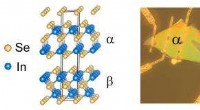 Ny enhed kan gøre varmeenergi til en levedygtig brændstofkildeDet venstre panel viser de skematiske gitterstrukturer i alfa-beta In2Se3 van der Waals metal-halvlederforbindelse, og det højre panel viser en optisk mikroskop af en forbindelsesenhed. Kredit:Yi Gu
Ny enhed kan gøre varmeenergi til en levedygtig brændstofkildeDet venstre panel viser de skematiske gitterstrukturer i alfa-beta In2Se3 van der Waals metal-halvlederforbindelse, og det højre panel viser en optisk mikroskop af en forbindelsesenhed. Kredit:Yi Gu -
 Forskeren rapporterer, hvordan seglceller dannes, kan være nøglen til at stoppe demUniversity of Houston lektor i kemi Vassiliy Lubchenko udforsker seglcellesygdom, som påvirker omkring 100, 000 amerikanere, mest afroamerikanere og latinamerikanere. Kredit:University of Houston
Forskeren rapporterer, hvordan seglceller dannes, kan være nøglen til at stoppe demUniversity of Houston lektor i kemi Vassiliy Lubchenko udforsker seglcellesygdom, som påvirker omkring 100, 000 amerikanere, mest afroamerikanere og latinamerikanere. Kredit:University of Houston
- Flower power:Sådan kommer du videre i annoncering
- Gamle pattedyrrester fordøjet af krokodiller afslører nye arter
- Skift til grøn spildevandsinfrastruktur kan reducere emissioner og give enorme besparelser, viser n…
- Twitter CEO siger, at virksomheden ikke er forudindtaget, ønsker sund debat
- Forskere afslører, hvordan myrterustpatogen bryder ind i en værtsplante
- Kan nutidens planter spore deres New Zealandske herkomst?


