Hvor mange gram jern skal der til for at reagere fuldstændigt med et overskud af ilt fra 40 jern3-oxid?
4Fe(s) + 3O2(g) --> 2Fe2O3(s)
Fra ligningen kan vi se, at 4 mol jern reagerer med 3 mol ilt for at producere 2 mol jern(III)oxid. Den molære masse af jern er 55,845 g/mol, og den molære masse af jern(III)oxid er 159,69 g/mol.
For at bestemme de gram jern, der skal til for at reagere fuldstændigt med et overskud af ilt for at danne 40 g jern(III)oxid, kan vi bruge støkiometri. Først skal vi beregne antallet af mol produceret jern(III)oxid:
40 g Fe2O3 / 159,69 g/mol =0,250 mol Fe2O3
Ifølge den afbalancerede kemiske ligning produceres 2 mol jern(III)oxid af 4 mol jern. Derfor er antallet af nødvendige mol jern:
4 mol Fe / 2 mol Fe2O3 * 0,250 mol Fe2O3 =0,500 mol Fe
Endelig kan vi konvertere mol jern til gram ved hjælp af jernets molære masse:
0,500 mol Fe * 55,845 g/mol =27,92 g Fe
Derfor vil der være brug for cirka 27,92 gram jern for at reagere fuldstændigt med et overskud af ilt og danne 40 gram jern(III)oxid.
Sidste artikelHvad laver fosfor og klor?
Næste artikelHvordan reagerer fosfor med vandig cuso4?
 Varme artikler
Varme artikler
-
 Hvordan formen påvirker en chokoladebars krystallinske strukturChokoladeforme påvirker chokoladens krystallinske struktur. Kredit:Popovphoto/Shutterstock.com Når du nyder en chokoladebar, de fleste mennesker tænker ikke over, hvordan molekylerne i det er orga
Hvordan formen påvirker en chokoladebars krystallinske strukturChokoladeforme påvirker chokoladens krystallinske struktur. Kredit:Popovphoto/Shutterstock.com Når du nyder en chokoladebar, de fleste mennesker tænker ikke over, hvordan molekylerne i det er orga -
 Bæredygtig kemi på kvanteniveauKredit:CC0 Public Domain At udvikle katalysatorer til bæredygtig brændstof- og kemisk produktion kræver en slags Goldilocks Effect - nogle katalysatorer er for ineffektive, mens andre er for uøkon
Bæredygtig kemi på kvanteniveauKredit:CC0 Public Domain At udvikle katalysatorer til bæredygtig brændstof- og kemisk produktion kræver en slags Goldilocks Effect - nogle katalysatorer er for ineffektive, mens andre er for uøkon -
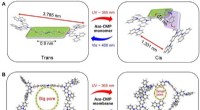 Mikroporøse polymermembraner til let-gatet iontransportSkematisk repræsentation af bottom-up designstrategien for konstruktion af kunstig lys-gatet ionkanalmembran. (A) Trans-cis-trans reversibel isomerisering af den syntetiserede azo-CMP-monomer og (B) d
Mikroporøse polymermembraner til let-gatet iontransportSkematisk repræsentation af bottom-up designstrategien for konstruktion af kunstig lys-gatet ionkanalmembran. (A) Trans-cis-trans reversibel isomerisering af den syntetiserede azo-CMP-monomer og (B) d -
 Fedtsyreråvarer muliggør en højeffektiv glyoxylat-TCA-cyklus til højudbytteproduktion af β-alan…(A) Sammenligning af metaboliske veje for bioproduktion af C4 tricarboxylsyre (TCA) cyklus mellemprodukter (OAA) fra FA eller glucose råvarer. (B) Design af glyoxylat-TCA-cyklus til effektiv produktio
Fedtsyreråvarer muliggør en højeffektiv glyoxylat-TCA-cyklus til højudbytteproduktion af β-alan…(A) Sammenligning af metaboliske veje for bioproduktion af C4 tricarboxylsyre (TCA) cyklus mellemprodukter (OAA) fra FA eller glucose råvarer. (B) Design af glyoxylat-TCA-cyklus til effektiv produktio
- Hvad er energiomdannelsen af vandkredsløbet SVAR VENLIGST ASAP!!!?
- Almindelige borgere hjælper med at bekæmpe den globale trussel om myggebårne sygdomme
- Stigende hav sætter saltholdighedsstress på hawaiianske kystplanter
- Kort udviklet med kunstig intelligens bekræfter lave niveauer af fosfor i Amazonas jord
- Klimaændringer forværrer global sult:FN
- Sådan konverterer du Z-Score til Percentages


