Hvilken gas har en masse på 1,66 g?
Den molære masse af kuldioxid (CO2) er 44,01 g/mol. Det betyder, at 1 mol kuldioxid har en masse på 44,01 gram. For at finde antallet af mol kuldioxid i 1,66 gram dividerer vi massen med molmassen:
1,66 g / 44,01 g/mol =0,0377 mol
Nu kan vi bruge den ideelle gaslov til at beregne volumenet af 0,0377 mol kuldioxid ved en temperatur på 25°C og et tryk på 1 atm. Den ideelle gaslov er:
PV =nRT
hvor P er trykket, V er rumfanget, n er antallet af mol, R er idealgaskonstanten, og T er temperaturen.
Ved en temperatur på 25°C, hvilket er 298,15 K, og et tryk på 1 atm, har den ideelle gaskonstant en værdi på 0,08206 L atm / mol K. Ved at indsætte disse værdier i den ideelle gaslov får vi:
V =nRT/P
V =(0,0377 mol) x (0,08206 L atm / mol K) x (298,15 K) / (1 atm)
V =0,904 L
Derfor er rumfanget af 1,66 gram kuldioxid ved en temperatur på 25°C og et tryk på 1 atm 0,904 L.
Sidste artikelEr det et godt videnskabeligt projekt at opløse piller med væsker?
Næste artikelHvad er plazmolyseret?
 Varme artikler
Varme artikler
-
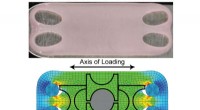 Kunstig brusk under spænding lige så stærk som naturmaterialeBrusk hverken heler eller regenererer efter skade, så kunstig brusk kunne hjælpe mange mennesker med led beskadiget af slid, skade eller sygdom. Lab-dyrket brusk dyrket med spænding (øverst) viser lig
Kunstig brusk under spænding lige så stærk som naturmaterialeBrusk hverken heler eller regenererer efter skade, så kunstig brusk kunne hjælpe mange mennesker med led beskadiget af slid, skade eller sygdom. Lab-dyrket brusk dyrket med spænding (øverst) viser lig -
 En katalysator for udviklingen af kulstofneutral teknologi for strålingsacceleratorenOperando blød røntgenabsorptionsspektroskopi baseret på strålingsaccelerator. Kredit:Korea Institute of Science and Technology (KIST) Betydningen af kulstofneutralitet vokser mere end nogensinde,
En katalysator for udviklingen af kulstofneutral teknologi for strålingsacceleratorenOperando blød røntgenabsorptionsspektroskopi baseret på strålingsaccelerator. Kredit:Korea Institute of Science and Technology (KIST) Betydningen af kulstofneutralitet vokser mere end nogensinde, -
 Oligomerer observerede at efterligne kombinationen af DNA-strengeKredit:CC0 Public Domain Et internationalt forskerhold har for første gang observeret dynamiske kovalente oligomerer, der efterligner kombinationen af komplementære DNA-strenge, hvilket kan føre
Oligomerer observerede at efterligne kombinationen af DNA-strengeKredit:CC0 Public Domain Et internationalt forskerhold har for første gang observeret dynamiske kovalente oligomerer, der efterligner kombinationen af komplementære DNA-strenge, hvilket kan føre -
 Nyt materiale baner vej for udåndingsprøvesensorer til at detektere kroniske sygdommeHovedbillede:Kunstnerens indtryk af 3-D nanopartikelstilladset, bestående af metalliske nanopartikler (gule) indlejret i halvledernanopartikler. Kredit:The Australian National University Et intern
Nyt materiale baner vej for udåndingsprøvesensorer til at detektere kroniske sygdommeHovedbillede:Kunstnerens indtryk af 3-D nanopartikelstilladset, bestående af metalliske nanopartikler (gule) indlejret i halvledernanopartikler. Kredit:The Australian National University Et intern
- Er snoede linjer fremtiden for adgangskodesikkerhed?
- Når naturkatastrofen rammer, mænd og kvinder reagerer forskelligt
- Er potteblandingen sur eller basisk?
- Team udvikler matematisk solver til analoge computere
- Buskbrande beskadigede australsk regnskov, der er hjemsted for jordens eneste levende eksemplarer af…
- Hvad sker der med bådene? Jordskælvet i Lissabon i 1755 og portugisisk tsunamilæsning


