Hvorfor er svovlbrinte en gas ved stuetemperatur?
Et stofs kogepunkt angiver styrken af dets intermolekylære kræfter. Jo stærkere de intermolekylære kræfter desto højere kogepunkt. Forbindelser med svage intermolekylære kræfter har lave kogepunkter.
H2S har et relativt lavt kogepunkt på -60,3 °C. Det betyder, at de intermolekylære kræfter mellem H2S-molekyler er svage. Disse svage kræfter er ikke nok til at holde H2S-molekyler sammen i en flydende eller fast tilstand ved stuetemperatur. Derfor eksisterer svovlbrinte som en gas ved stuetemperatur.
De svage intermolekylære kræfter i H2S skyldes dets molekylære struktur. H2S er et polært molekyle, hvilket betyder, at det har en positiv ende (brintatomerne) og en negativ ende (svovlatomet). Polariteten af H2S er dog ikke særlig stærk. Dette skyldes, at elektronegativitetsforskellen mellem brint og svovl er relativt lille. Den lille forskel i elektronegativitet resulterer i en svag delvis positiv ladning på brintatomerne og en svag delvis negativ ladning på svovlatomet.
Den svage polaritet af H2S betyder, at de intermolekylære kræfter mellem H2S-molekyler er svage. Dette resulterer i et lavt kogepunkt og eksistensen af H2S som en gas ved stuetemperatur.
Sidste artikelHvor bliver det kulstof, der fjernes under citronsyrecyklussen?
Næste artikelHvad er NaCl plus H2O CO2 (g)?
 Varme artikler
Varme artikler
-
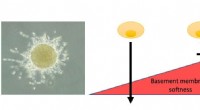 Ny opdagelse kan muliggøre præcis forudsigelse af kræftspredning, før kræft udvikler sigVENSTRE:Spheroid af brystkræftceller, der bryder gennem basalmembranen for at invadere i det omkringliggende område. Denne evne bestemmes af forholdet mellem netrin-molekyler til stede i basalmembrans
Ny opdagelse kan muliggøre præcis forudsigelse af kræftspredning, før kræft udvikler sigVENSTRE:Spheroid af brystkræftceller, der bryder gennem basalmembranen for at invadere i det omkringliggende område. Denne evne bestemmes af forholdet mellem netrin-molekyler til stede i basalmembrans -
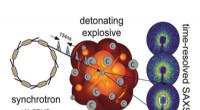 De første amerikanske eksperimenter nogensinde på et nyt røntgenanlæg kan føre til bedre eksplo…Detonationen af kulstofrige højsprængstoffer giver fast kulstof som en hovedbestanddel af produktblandingen, og afhængigt af de termodynamiske forhold bag stødfronten, en række carbonallotroper og -
De første amerikanske eksperimenter nogensinde på et nyt røntgenanlæg kan føre til bedre eksplo…Detonationen af kulstofrige højsprængstoffer giver fast kulstof som en hovedbestanddel af produktblandingen, og afhængigt af de termodynamiske forhold bag stødfronten, en række carbonallotroper og - -
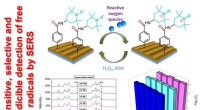 Forskere skaber sensorer med fælder til frie radikalerSensor drift diagram. Kredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University og partnere fra Tjekkiet og Frankrig har designet ekstremt følsomme sensorer til frie iltholdi
Forskere skaber sensorer med fælder til frie radikalerSensor drift diagram. Kredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University og partnere fra Tjekkiet og Frankrig har designet ekstremt følsomme sensorer til frie iltholdi -
 Teknik til at genvinde fosfor fra urinFosfor er en vigtig ingrediens i mange gødninger, der bruges til at hjælpe med at dyrke vores plantebaserede fødevarer. Kredit:Shutterstock/otick Fosfor, nummer 15 i det periodiske system, kan vær
Teknik til at genvinde fosfor fra urinFosfor er en vigtig ingrediens i mange gødninger, der bruges til at hjælpe med at dyrke vores plantebaserede fødevarer. Kredit:Shutterstock/otick Fosfor, nummer 15 i det periodiske system, kan vær
- At tale med amerikanere afslører mangfoldigheden bag den fælles mening, at landet er på den forke…
- Hvordan gejsere virker
- Typer af gas svejsning
- Hurtigste vækstplanter til et videnskabsprojekt
- Denne supermåne har et twist – forvent oversvømmelse, men en månecyklus maskerer virkningerne af …
- Spillefirmaet afgør VR-sag med Facebook-ejede Oculus


